Model-based Systems Engineering
Medizinprodukte in 5 Etappen entwickeln
Der MedTech-Weg führt von der Idee bis zum Ende des Lebenszyklus: Regulatorische Fragen, die Design-Entwicklung, Hard- und Software mit Cybersecurity sowie UX-, UI-, und Industriedesign. Model-based Systems Engineering hilft, Medizinprodukte schneller und mit weniger Risiko zu launchen.
Zu Beginn eines jeden Medizinprojekts steht die Idee für ein Produkt, das ein neues Marktsegment erschließen oder optimieren soll. Wie der Weg bis zum Markteintritt aussieht, zeigt beispielhaft der Referenzfall eines mittelständischen Medizinprodukteherstellers: Mittels Ultraschall-Technologie soll der Blutfluss eines Menschen messbar gemacht werden.
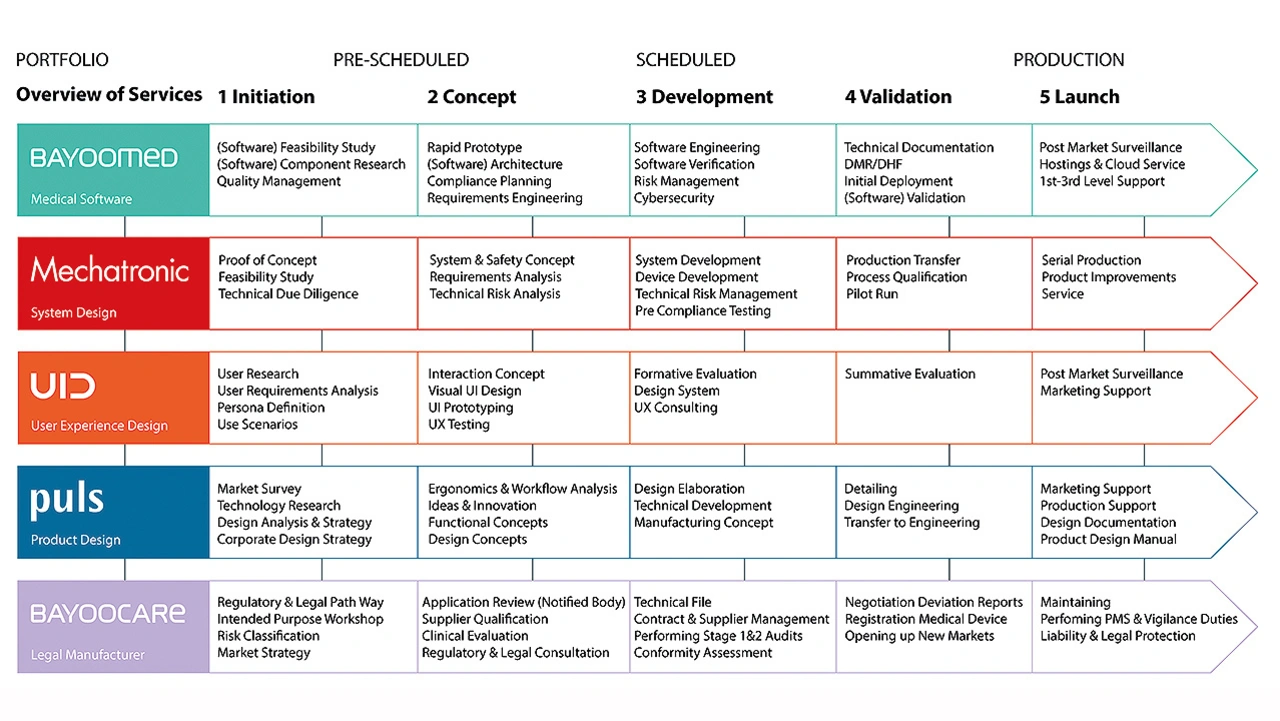
Ein digitaler Prototyp des Ultraschallgeräts und eine erste klinische Prüfung sind die Basis für die fünf involvierten Fachexperten Bayoocare (Regulatory Affairs), Bayoomed (Software und Begleitprozesse), Mechatronic (Hardware und Systems Engineering), Puls Produktdesign (UX) und UID (User Interface, Research), die den deutschen MedTech-Hersteller bei der Realisierung unterstützen (Bild 1). Gemeinsam entwickeln sie einen ersten realistischen Entwurf und definieren Besonderheiten, die in der Produktion zu beachten sind.
| Kurz erklärt: Prototyping für Medizinprodukte |
|---|
| Prototyping für Medizinprodukte hilft dabei, das Produktkonzept entwicklungsbegleitend auf die Anforderungen im medizinischen Umfeld optimal auszurichten und bereits zu testen. Dies spart kostenintensive Korrekturen. Auch die DIN EN 62366 und FDA fordern eine entwicklungsbegleitende formative Evaluation der Medizintechnik, idealerweise mit repräsentativen Nutzern |
Produktleben in mehreren Etappen
Die Anforderungen an das Ultraschallgerät: Für den Anwendungsfall wünscht sich der Hersteller als essenzielle Anforderung ein dunkles UI-Design, da das Gerät in abgedunkelten Umgebungen, wie Neonatal Intensive Care Units (NICUs) und Inkubatoren, genutzt wird. Zudem soll eine Alarmfunktion für das Unter- bzw. Überschreiten definierter Grenzwerte integriert werden. Durch die Anbindung an das Krankenhausinformationssystem ist zudem Cybersecurity eine zentrale Anforderung. Nun beginnt die erste Phase der Journey für das Medizinprodukt der Risikoklasse IIb.
Etappe 1: Die Initiierung
Eine erste entscheidende Frage, aufgrund derer sich die weiteren Phasen entwickeln, ist: Welche Zielmärkte strebt der Hersteller für eine Zulassung des neuen Medizinprodukts an? Die Entscheidung für das Ultraschallgerät fällt auf den europäischen Raum und somit für die Produktklassifizierung gemäß Medical Device Regulation MDR (2017/745) – mit der Option, ebenso eine Zulassung für den amerikanischen und kanadischen Markt (MDSAP) zu ermöglichen.
Der Legal-Dienstleister übernimmt dabei das Erstgespräch mit der Benannten Stelle und prüft, wie für das Medizinprodukt ein schneller Marktzugang möglich ist. Im Zuge dessen wird unter einem Framework Agreement ein Application Review geplant und vereinbart. Die Grundlagen für das später folgende Risikomanagement, die Gebrauchstauglichkeitsprüfung sowie die Klinische Bewertung und die Technische Dokumentation werden gelegt.
Parallel beginnen die Experten mit verschiedenen Recherchearbeiten: Welche Komponenten wie Hardware und Software sowie Technologien sind die optimale Wahl für das Ultraschallgerät? Für welche potenziellen Nutzer und welches Marktsegment wird das Medizingerät gebaut? Wer sind prototypische Nutzer, was sind ihre Wünsche, Bedürfnisse und Ziele? Darauf aufbauend entwickeln die Experten eine Durchführbarkeitsstudie und definieren Personas. Am Ende der ersten Etappe steht eine Strategie, welche die Basis für ein weiterentwickeltes Konzept darstellt.
Etappe 2: Das Konzept
In der zweiten Entwicklungsetappe geht es darum, die Wünsche des Kunden in ein Model-based System Design zu überführen. Der projektverantwortliche Systemarchitekt erstellt dafür ein SysML/UML-Modell, das alle Anforderungen an das Gesamtsystem sowie an die einzelnen Disziplinen Mechanik, Elektronik, Software, UX-, UI- und Industriedesign berücksichtigt. Die technische Risikoanalyse wird mittels Fault Tree Analysis (FTA) direkt ins Modell eingebunden. Testfälle werden im Rahmen der Modellierung aufgeplant. Es entsteht das Gerüst für eine vollständige Traceability von Requirements über Use Cases und Detailed Design bis hin zum Testing. Dabei werden alle für das Medizingerät notwendigen, risikominimierenden Maßnahmen einbezogen.
Die Entwicklung eines ersten Prototyps für die Softwarearchitektur und das UI-Design beginnt. In enger Abstimmung erstellen alle fünf Experten Konzepte für ihre Fachbereiche. Am Ende der Etappe liegen für die Entwicklungsphase Konzepte für die System- und Sicherheitsarchitektur (Hardware sowie Software) vor. Entsprechendes gilt für die Verbindungstechnik zur Interaktion mit dem Gerät sowie dessen Funktionen, das Industrie-Design und die Visualisierung innerhalb der Software (UX-, UI-Design).
Etappe 3: Die Entwicklung
Alle Prozesse greifen während der gesamten Entwicklungsreise ineinander und bedingen sich gegenseitig. Der regelmäßige und zuverlässige Austausch unter allen Partnern ist dabei unabdingbar.
Wie wird das Ultraschallgerät nun nutzungsfreundlich und ansprechend umgesetzt? Dieser Frage widmen sich die Produktdesigner. Neben der Ästhetik ist vor allem wichtig, dass das Medizingerät nicht zu groß ist, um es problemlos im Klinikalltag zu integrieren. Dennoch muss die notwendige Technik mit passenden Abständen eingebaut werden, nicht nur um eine passive Kühlung zuzulassen und ein Überhitzen der Hardware zu vermeiden, sondern auch um die MOPP-Standards für Luft- und Kriechstrecken gemäß MDR einzuhalten. Gemeinsam mit den Medizintechnikentwicklern gestalten die Produktdesign- und UI-Teams das Ultraschallgerät mit allen Hardware-Anforderungen und optimiertem UX- und Industriedesign.
Um dem Klinikpersonal einen einfachen Umgang mit dem Ultraschallgerät zu ermöglichen, ist ein logisch aufgebautes und intuitiv nutzbares UI-Design von großer Bedeutung. So entwickeln UI- und UX-Designer gemeinsam Lösungen zur einfachen Navigation im System, dem Anzeigen von Patienteninformationen und der Visualisierung von Messdaten. Maßgebend ist dabei das Vorgehen nach ISO 9241 (Human Centered Design) in Verbindung mit der IEC 62366 (Application of Usability Engineering to Medical Devices).
Die Softwareentwickler setzen nun das optische Design inklusive einer bedarfsgerechten Usability für das Ultraschallgerät um (Software Engineering und Verifizierung). Die System- und Softwarearchitekten sowie der Cybersecurity-Experte prüfen Schnittstellen zum Krankenhausinformationssystem, um Datensicherheit und Zugriffsschutz von Beginn an in der Architektur zu etablieren. Denn die Patientendaten sollen nicht auf dem Medizingerät, sondern zentral im Krankenhausinformationssystem gespeichert werden, um die direkte Weiterverarbeitung zu ermöglichen.
Immer bedeutsamer für kritische Infrastrukturen ist das Thema Cybersecurity – so auch bei der Entwicklung des Ultraschallgeräts. Damit die Software nicht gehackt und die Patientensicherheit gewahrt werden kann, plant das Team verschiedene Mechanismen zur Datensicherung und Zugriffsbeschränkung inklusive der Verwendung von HMAC Hardware ICs, um die Benutzung von unsicheren Plagiaten der Ultraschallsensoren zu unterbinden.
Das Risikomanagement begleitet den gesamten Entwicklungsprozess. Nur so können Fehler bei der Entwicklung oder auch der späteren Fertigung des Medizinprodukts vermieden werden. Kann es passieren, dass das Ultraschallgerät versehentlich in ein MRT eingebracht wird, wo die Magnetresonanzen zu einem Risiko für Patienten führen könnten? Könnte das Auslösen eines technischen Alarms durch Hardware- oder Softwarefehler verhindert werden, wodurch Patienten, vermittelt durch mögliche fehlerhafte Diagnosen, gefährdet würden?
Mit möglichen Risiken wie diesen befassen sich die Software- und Hardwareentwickler im Zuge der Risikoanalyse. Mittels normativer Pre-Compliance-Tests prüfen die Entwicklungsingenieure am Prototyp außerdem: Sind alle Normen und Anforderungen der IEC 60601-1 und etwaiger Spezial- und Unternormen erfüllt? Bestehen noch mögliche Projektrisiken, die es zu minimieren gilt? Gleichzeitig beginnt das Testen der Usability. Anhand einer formativen Studie stellen die Experten sicher, dass eine individuelle Steckverbindung mit Farbcodierungen den Nutzern die Handhabung anzeigt und das medizinische Personal erwartungskonform auf etwaige Alarme und Fehlermeldungen reagieren kann.
Etappe 4: Verifizierung und Validierung
Mittels einer sorgsam abgewogenen Mischung aus automatisierten und manuellen Testverfahren prüfen und verifizieren Software- und Hardwareentwickler ihre Lösungen auf Nutzbarkeitsdauer und systematische Fehler. Eine abschließende summative Studie bringt zusätzliche Ergebnisse.
Die Technische Dokumentation wird durch die jeweiligen Zulieferer und Entwickler fertiggestellt und durch den Legal-Dienstleister zusammengeführt. Mit Fertigstellung und Übermittlung der Technischen Dokumentation an die Benannte Stelle kann das Konformitätsbewertungsverfahren beginnen und der Produkt-Launch geplant werden.
Etappe 5: Die Produkteinführung
Im fünften und finalen Schritt übernimmt der Legal-Dienstleister mithilfe eines Vertriebspartners den Marktzugang. Im Referenzbeispiel konnte das Ultraschallgerät der Risikoklasse IIb den gesamten Entwicklungsprozess bis zum Markteintritt innerhalb von zweieinhalb Jahren durchlaufen. Eine Leistung, die vor allem durch die enge Zusammenarbeit aller Fachexperten möglich war. Trotz der Schnelligkeit im Entwicklungsprozess wurde selbstverständlich eine hohe Qualität des Medizingeräts erzielt, der Abweichungsbericht der Benannten Stelle wies nur wenige Punkte auf.
Mit dem erfolgreichen Produktstart ist der Lebenszyklus des Ultraschallgeräts noch in vollem Gange. So pflegen die Teams für System- und Softwareentwicklung, Regulatory Affairs und UI-Design die Post Market Surveillance. Zudem stehen die Experten für Marketing- und Produkt-Support-Anfragen zur Verfügung und unterstützen als 1st, 2nd und 3rd Level bei eventuellen technischen Komplikationen.
| Die letzten regulatorischen Schritte bis zum Medizinprodukt |
|---|
| Nach erfolgreichem Stage 1 und Stage 2 Audit sowie Konformitätsbewertungsverfahren übermittelt der Lead Auditor die Akte an den Zweit-Auditor. Nach dessen Freigabe wird die Akte der Zertifizierungsstelle zur Freigabe vorgelegt und nach deren Freigabe, erstellt die Benannte Stelle Zertifikate für das Medizinprodukt. Hiermit kann das Produkt bei der EUDAMED Datenbank registriert und somit konstitutiv zu einem Medizinprodukt werden. Mit Anbringung des CE-Kennzeichens sowie der vom Hersteller ausgestellten Konformitätserklärung ist das Medizinprodukt zur erstmaligen Abgabe bereit. |
Model-based Systems Engineering
Der Praxisfall zeigt: Um Medizingeräte möglichst effizient, zügig und fehlerfrei zur Produktreife zu bringen, sollte die Entwicklung ganzer Systeme in Struktur und Verhalten auf grafische Art und Weise in einem modernen, vollumfassenden Systemmodell beschrieben werden. Mit dem beschriebenen Model-based Systems Engineering entsteht automatisch eine durchgängige, konsistente und belastbare Entwicklungsdokumentation – beginnend mit Use Cases und Anforderungen, über Architektur und Design hinweg bis hin zum Test. Volle Traceability in allen Disziplinen und über alle Ebenen entsteht ohne Zusatzaufwand durch die Arbeit am Modell. Eine einheitliche projektweite Terminologie wird sichergestellt und gefährliche Redundanzen durch die zentrale Datenhaltung in einem einzigen Systemmodell konsequent vermieden. Selbst das Risikomanagement ist mittels Fehlerbaumanalyse (FTA, Fault Tree Analysis) nahtlos und vollumfänglich im Modell integriert.





