Digitaler Batteriepass | EU-Verordnung
Operation Akkupack in der Medizintechnik
Batteriepass, Austauschbarkeit, Sorgfaltspflichten: Die neue EU-Batterieverordnung sorgte für Verunsicherung. Doch kleine und mittlere Medizintechnik-Unternehmen profitieren jetzt von deutlichen Vereinfachungen. Was wirklich zu beachten ist und wie dynamische Daten neue Geschäftsmodelle ermöglichen.
Immer mehr medizinische Geräte sind kabellos. Dabei gilt es, die neue EU-Batterieverordnung (2023/1542) umzusetzen, die im August 2023 verabschiedet und ist am 18. Februar 2024 in Kraft getreten ist. Sie ersetzt die EU-Batterierichtlinie 2006/66/EG und enthält als Teil des europäischen »Green Deal« Regelungen für Nachhaltigkeit, Kreislaufwirtschaft, Lieferkettentransparenz und Vereinheitlichung von Bestimmungen zu Batterien und Akkus in sämtlichen erdenklichen Einsatzbereichen. In Deutschland wurde am 18. August 2025 das Batteriegesetz (BattG) durch das Batterie-Recht-Durchführungsgesetz (BattDG) ersetzt. Unter anderem schreibt dieses vor, dass Akkusysteme einen sogenannten digitalen »Batteriepass« bekommen müssen.
Informationen zum Batterie-Lebenszyklus
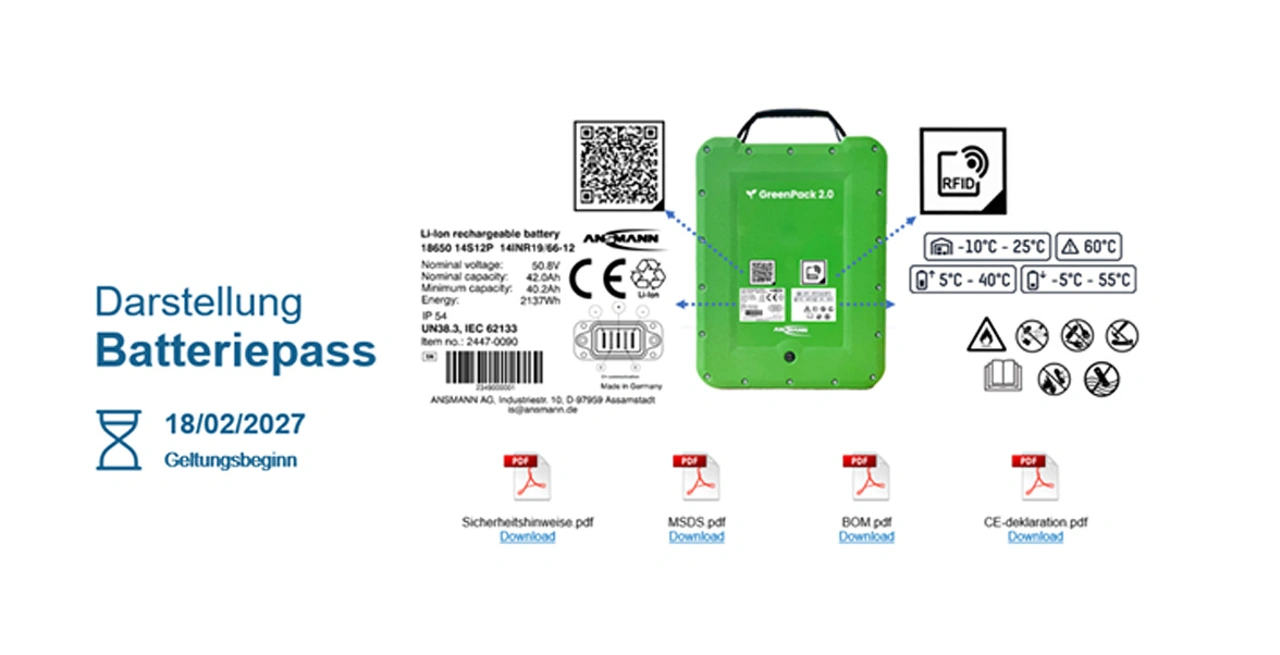
Dieser digitale – von Hersteller, Importeur und Händler in einer Datenbank zu hinterlegende - Batteriepass enthält Informationen über den gesamten bisherigen und zu erwartenden Batterie-Lebenszyklus, die vom Produzent, Importeur und In-Verkehr-Bringer digital in einer Datenbank hinterlegt werden müssen. Dies betrifft insbesondere folgende Kategorien: Einzigartige Seriennummer für Rückverfolgbarkeit, Materialherkunft insbesondere gefährlicher Inhaltsstoffe oder kritischer Rohstoffe wie Kobalt, Blei, Lithium, Graphit oder Nickel, Produktion und CO2-Abdruck, zu erwartende Lebenszyklen in der betreffenden Anwendung, Herstellerdaten/Reparaturmöglichkeiten, Materialzusammensetzung/ Recyclingfähigkeit, Entsorgungsvorschriften. Der Fokus liegt dabei erkennbar auf Daten, die für eine mittelfristig bessere Kreislaufwirtschaft von Zellen und Akkusystemen benötigt werden.
Im Umfeld gab es dabei einige Verwirrung welche Teile der neuen EU-Batteriegesetzgebung nun für welchen Batterietyp relevant sei. Ob Bereiche – wie der medizintechnische Einsatzbereich - evtl. Ausnahmen aufweisen. Zudem wurden kurzfristig im Rahmen der Bürokratie-Vereinfachungsverfahren der EU - kurz Omnibus, in diesem Fall Omnibus IV - einige Regelungen ausgesetzt, nur für bestimmte Batterietypen in Kraft gesetzt und verschoben.

Zelldatenbank für die meisten Batterietypen
Die Akku- und Ladesystem-Experten von Ansmann bauen seit einigen Jahren mit einem dedizierten Team in Assamstadt eine Zelldatenbank mit hunderten von Zellsorten verschiedenster, Formen, Chemien, Kapazitäten und Verhaltensweisen auf. Im hauseigenen Zelllabor werden verschiedenste Akkuzellen auf Herz- und Nieren und in verschiedensten Umgebungsbedingungen geprüft. Mehr als 400 unterschiedliche Zellen – über 300 Rundzellenarten, 60 prismatische und 40 sonstige - sind aktuell in der hauseigenen Zelldatenbank erfasst – qualifiziert und vermessen im neuen internen Batterielabor. Neben den weltbekannten koreanischen und chinesischen Zellherstellern sind mit Murata, Eve, BAK, Great Power, Haidi und anderen auch europäische und internationale Hersteller im Angebotsportfolio, die ansonsten selten in die Auswahl geeigneter Akkuzellen einbezogen werden. Darunter auch eine ganze Reihe von Zellen, von denen aufgrund besonders herausragender Eigenschaften und Messergebnisse genau ein Zelltyp des jeweiligen Herstellers in die Zelldatenbank aufgenommen wurde. Die Datenblätter der Zellhersteller verraten nämlich in der Regel nur einen begrenzten Teil der Wahrheit und nur unter Idealbedingungen. Präventive, systematische Messreihen – wenn nötig auch über Monate hinweg und nach dem Zellausfall - hingegen schaffen Klarheit über die wirkliche Eignung eines Zelltyps für die jeweilige Anwendung.
KI simuliert Formgebung und Leistung
Auf diese Weise ist es möglich in kürzester Zeit die optimalen Zellen für jede noch so herausfordernde Anwendung zu identifizieren. Ein zusammen mit einem IT-Partner eigenentwickelte KI zur Simulation von Formgebung und Leistungsdaten reduziert die Kosten und time-to-market-Zyklen in der Entwicklung zusätzlich.
Und was ist nun neu, das auch die Medizintechnik betrifft? Kurz vorab: Die Anforderungen variieren dabei natürlich weiterhin wie bisher auch, gemäß der bestehenden gesetzlichen Regelungen, je nach medizintechnischer Geräte- und Sicherheitseinstufung. Somit nach Einsatz im Beatmungsgerät, Defibrillator, zahnmedizinischen Laborzubehör, Patientenmonitor für den mobilen Einsatz, Infusionspumpe, elektronische Pipette und -pumpe, Patientenbett oder Rollstuhl, CPAP-, EKG- und Ultraschallgerät, Hörgerät, Herzschrittmacher und Insulinpumpe oder chirurgische Instrumente oder Fieberthermometer uvm. An den medizintechnischen Regularien ändert die gesamte Batteriediskussion nichts. Zielbereich sind ausschließlich die Batterie- und Akkusysteme der mobilen medizintechnischen Geräte.
Ausnahmen für die Medizintechnik
Eine besondere Ausnahme sei hierbei gleich zu Beginn erwähnt: Ab 2027 muss eigentlich der Austausch von Akkus in Gerätebatterien möglich sein, um die Lebensdauer der Geräte zu verlängern und das Recht auf Reparatur der Geräte-Endnutzer zu gewährleisten. Außerdem muss der Inverkehrbringer sicherstellen, dass die Batterien mindestens fünf Jahre lang nach dem Inverkehrbringen für Endnutzer als Ersatzteile für die von ihnen betriebenen Geräte erhältlich sind.
Hier gibt es eine Ausnahme, die medizintechnische Geräte sehr häufig betrifft: wenn aus Austausch im Interesse der Robustheit (also Staub- oder Wasserdichtigkeit z.B. beim Abspülen) oder aus sicherheitstechnischen Gründen (z.B. bei einem Einsatz in Geräten der festen Einbau voraussetzt wie in Endoskopen) verbietet, geht die Sicherheit vor und die Austauschbarkeit darf entfallen. Auch bei z.B. Pufferbatterien ist der festen Datenverbindung Vorrang eingeräumt. Gerne erwähnte Beispiele für solche Ausnahmen sind Geräte für die professionelle medizinische Bildgebung und Strahlentherapie und In-Vitro-Diagnostik. Im Detail ist dies mit der zulassenden Stelle zu klären. Ebenso entfällt die Austauschbarkeitspflicht wenn die praktische Lebensdauer des Geräts eindeutig kleiner ist als der zu erwartende Lebenszyklus der Zellen.
Batteriepass vs. ältere Verordnungen
Interessant ist zudem die Informationspflicht die darin mündet, dass jedes Gerät einen digitalen Batteriepass haben muss. Neu ist hierbei im Vergleich zur bisherigen Meldepflicht und Datenbank, dass dieser Batteriepass grundsätzlich nicht nur statische, sondern auch dynamische Daten über die Batterie und ihre Performance enthält. Gerade für hochwertige mobile Geräte - und damit auch viele medizintechnische Geräte - bietet dies nach Ansicht der Entwickler von Ansmann eine Vielzahl neuer Möglichkeiten. Die statischen Daten sind Herstellerinformationen, Konformitätserklärung, CO2-Fußabdruck, Rezyklatanteil und Informationen zur Demontage und Reparatur. Tracking wird einfacher und die Betriebsplanung kann optimiert werden.
Werden zudem dynamische Daten ausgelesen, z.B. zu Kapazität, Zyklen und Fehlern lassen sich durch intervallbezogene oder Echtzeitüberwachung hervorragende Produktoptimierungen, Predictive-Maintenance und Service-Cases für den Gerätehersteller und dessen Kunden kreieren. Möglich werden durch die Auswertung von Livedaten der Zellen und Batterieblöcke dann zum Beispiel Garantieverlängerungen. Bei einem Zahntechnikgerätehersteller ließ sich auf diese Weise die Lebensdauer eines Geräts um mehr als 50 Prozent verlängern. Zudem kann eine Analyse des Nutzungsverhaltens in der Anwendung und ein Abgleich mit Spezifikationen wie z.B. mechanische Belastungen durch Stürze eine neue Grundlage bieten für die einfachere Schadensanalyse für OEM´s und Versicherungen.
Wenig Grund zur Aufregung für Medizintechnik
Batteriepass (»Informationspflichten«-Erfüllung) ist also vorbereitet und machbar – und ist wohl tatsächlich eine Voraussetzung, um mittelfristig eine zukunftsfähige Akku-Kreislaufwirtschaft zu schaffen. Dann die oben genannte Reparaturfähigkeit und Austauschbarkeit, die ebenfalls nachvollziehbar ist. Ansmann hatte hierzu sowie zu Kunststoffrezyklaten in Akkupacks ohnehin schon eigene Projekte am Start.
Darüber hinaus gab es jedoch einige Punkte, die die mittelständischen Importeure und Händlern von Zellen vor Herausforderungen stellen: Darunter die Sorgfaltspflichten, die sich beispielsweise auf Rohstoff-Herkunfts- und sonstigen Lieferkettennachweise beziehen. Im Detail sollen diese hier nicht noch einmal wiederholt werden. Die zentrale Frage nämlich: Was wurde daraus und wie wird diese die Medizintechnik-Hersteller mitbetreffen?
Kurzfazit: Es besteht wenig Grund zur Aufregung für medizintechnische Unternehmen. Der erste Grund hierfür liegt in der Reichweite der meisten Regelungen der neuen EU Batt-VO, jenseits des Themas Batteriepass / Informationspflichten. Etliche sehr aufwändige Regelungen der Batt-VO hatten nämlich von Anfang an nur die Großbatterien (»tragbare Industriebatterien, stationäre Batterie-Energiespeichersysteme, Elektrofahrzeug- und leichte Transportmittelbatterien und Starterbatterien«) im Auge. Wenig verwunderlich, hier lohnt das Sammeln und Recyclen mehr. Erste Recyclinganlagen und Dual-Use Konzepte existieren bereits.
Für die »normale« medizintechnische kleine mobile Gerätebatterie ist EU-seitig seit jeher kein CO2-Fußabdruck und sind keine Mindestrezyklats-Bestimmungen oder besondere Nachweispflichten bei neuen Batteriearten geplant.
Verschiebung der Sorgfaltspflichten willkommen
Auch für die normalen Gerätebatterien relevant gewesen wären jedoch die in der Batt-VO neu auferlegten Lieferketten-Sorgfaltspflichten. Deren im Sommer kurz vor in Kraft treten beschlossene Verschiebung um zwei Jahre auf den 18. August 2027 war sehr willkommen. Und noch weitgehender: Letztlich wurden diese beim aktuellen EU-Omnibus IV zur Vereinfachung der Bürokratie insbesondere für Kleine und mittelständische Unternehmen weitgehend abgeräumt.
Neu eingeführt wurde im Rahmen der Omnibus-Bürokratie-Vereinfachungsdiskussionen eine neue Unternehmens-Größenkategorie. Hierin neu definiert wurden die sogenannten »Small-Mid-Cap-Unternehmen«, unter die ein Großteil der europäischen Akku-Importeure, Konfektionäre und viele Gerätehersteller fallen. Diese sollen ebenso wie die klassischen Kleinen und mittelständischen Unternehmen von zu starker Regulierung bei Datenschutz, Berichtspflichten und Kapitalmarktzugang entlastet werden.
»Diese SMC-Firmen sind Unternehmen mit mittlerer Marktkapitalisierung, die keine kleinen oder mittleren Unternehmen im Sinne der Empfehlung 2003/361/EG mehr sind, die jedoch weniger als 750 Mitarbeitende haben und entweder weniger als 150 Millionen EUR Umsatzerlös oder eine Bilanzsumme von weniger als 129 Millionen EUR vorweisen,« wie die Cattwyk Rechtsanwaltsgesellschaft aus Hamburg auf ihrer Webseite erklärt. Letztlich soll damit offenbar verhindert werden, dass zu viele Unternehmen als »Großunternehmen« eingestuft und durch übermäßige Verpflichtungen erdrückt werden.
Fakt: Nicht nur die klassisch definierten KMU (unter 40 Mio Umsatz), sondern auch diese SMCs (Small Mid-Caps) sollen von den Vorschriften über die Lieferketten Sorgfaltspflichten und die Rückverfolgung von Lieferketten für Batterierohstoffe ganz ausgenommen werden (Änderungsvorschlag Kap. 47). Bisher lag diese Grenze bei 40 Millionen Euro. Für Unternehmen aller Größen für die die Batt-VO gilt, soll außerdem eine Reporterleichterung gelten: Die öffentliche Berichterstattung in Bezug auf die Sorgfaltspflichten soll nur erstmalig innerhalb eines Jahres ab dem Anwendungsbeginn und dann nur noch alle drei Jahre und nicht mehr jährlich erfolgen. (uh)
+++ Der Hintergrund in der EU +++
Begründet wird die Verschiebung im Papier der Kommission in verschiedenen Papieren mit der Angleichung an das – neue entschärfte - Lieferkettengesetz - die CSDDP. Was offenkundig sinnvoll ist, jedoch vermutlich, weil unterschiedliche Referenten daran arbeiteten, bislang nicht berücksichtigt wurde. Denn letztlich handelt es sich ja um eine »Lieferkettenregulierung« für Batterien von der Mine bis zum Recyclingprozess. Darüber hinaus hätte die Europäische Kommission gemäß mehrerer internationaler Kanzleien gemäß Art. 48 Abs. 5 Batterieverordnung bis zum 18. Februar 2025 Leitlinien zu den Sorgfaltspflichten der Art. 48, 49, 50 und 52 veröffentlichen müssen. Nationale Behörden, i.S. neutraler nationaler Notifizierungsstellen, die für die Abwicklung zuständig sind, wurden ebenfalls noch nicht benannt. Immerhin ist vor wenigen Wochen in Deutschland im Bundestag (am 11. September 25) das der neuen EU-Verordnung angepasste aktualisierte BattDG – Batterierecht-Durchführungsgesetz verabschiedet worden, das ein wenig Klarheit über die notwendigen Meldeschritte und damit bringt.
Die – bislang vier - Omnibus-Initiativen, die von Kritikern zum Teil als Verwässerung ursprünglicher u.a. GreenDeal/Nachhaltigkeits-Beschlüsse gesehen werden, und die in ihnen enthaltenen »Stop-the-clock«-Maßnahmen zur Verschiebung bereits beschlossener Berichtspflichten etc. werden mit den Konsequenzen der Berichte von Mario Draghi und Enrico Letta zur (mangelnden) Wettbewerbsfähigkeit der EU unter sich dramatisch wandelnden globalen Rahmenbedingungen begründet. Der Begriff »Omnibus-Verordnung« wird in der Europäischen Union verwendet, um Rechtsakte zu beschreiben, die mehrere bestehende Verordnungen oder Richtlinien gleichzeitig ändern oder aktualisieren. Darunter in Omnibus IV – auch einige Elemente der Batt-VO.
Zuvor war fehlende freiwillige Zusammenarbeit zwischen den EU-Ländern offenbar der Grund, warum es überhaupt zu dieser neuen EU-weiten Batterie-Verordnung kam. Da die zuvor bestehende Richtlinie – im Unterschied zur Verordnung als automatisch in allen Ländern geltendes Gesetz - den nationalen Umsetzungen obliegt, hätten die EU-Länder freiwillig und gemeinsam einen sinnvollen Rahmen für eine Batterie-Kreislaufwirtschaft schaffen müssen. Seit Inkrafttreten der Richtlinie 2006 wurde in den ersten 15 Jahren deutlich, dass die entsprechenden nationalen Umsetzungen bei weitem nicht genügen werden, um eine gemeinsame Akku-Kreislaufwirtschaft innerhalb der gesamten EU bezüglich Abfallsammlung und -verwertung möglich zu machen.
Die Begründung für die Ermächtigung der EU in dieser Frage auch verbindliche Verordnungen zu erlassen, wurde dann aus einem der Hauptziele der EU abgeleitet: der Harmonisierung des Binnenmarkts. Die Batt-VO wurde als notwendig erachtet, um das reibungslose Funktionieren des Binnenmarkts unter Maßgabe des Umweltschutzes zu ermöglichen, so die Begründung der Kommission. Die Mitgliedstaaten könnten dies nicht alleine erreichen. Die Kriterien Verhältnismäßigkeit und Subsidiarität – zwei zentrale Voraussetzungen dass die EU zur Gesetzgebung ermächtigt ist - seien daher gewahrt und die neue zentrale Verordnung durch EU-Gesetzgebung rechtmäßig.





