Software | Funktionelle Neurochirurgie
Besser dank Technik: Tiefe Hirnstimulation
In der funktionellen Neurochirurgie leiten bildgebende Verfahren Ärzte bei stereotaktischen Eingriffen an; die intraoperative Bildgebung verbessert die »Tiefe Hirnstimulation« und Epilepsiebehandlung. Mit Hard- und Software lassen sich mehr neurologische und psychiatrische Indikationen behandeln.
Die funktionelle Neurochirurgie (FSN) ist ein Teilgebiet der Neurochirurgie, in dem die Symptome von Erkrankungen des zentralen Nervensystems – wie Parkinson, Dystonie, essenzieller Tremor und medikamentenresistente Epilepsie – durch Veränderung der Funktion spezifischer Zielstrukturen im Gehirn und der neuronalen Schaltkreise innerhalb dieser behandelt werden.
Die technischen Möglichkeiten zur Identifikation dieser Zielstrukturen durch bildgebende Verfahren waren lange Zeit begrenzt – insbesondere aufgrund unzureichender Kontraste und eingeschränkter räumlicher Auflösung. Therapeutische Maßnahmen, wie etwa die »Tiefe Hirnstimulation« (Deep Brain Stimulation, DBS), mussten und müssen daher immer noch häufig durch zusätzliche intraoperative Methoden wie mikroelektrophysiologische Aufzeichnungen und klinische Testungen im wachen Zustand abgesichert werden. Die komplexen Abläufe bedeuteten einen hohen logistischen, personellen und zeitlichen Aufwand, sowohl für das medizinische Team als auch für die PatientInnen.
In den letzten Jahren hat sich dieses Bild grundlegend gewandelt: Fortschritte in der Magnetresonanztomographie (MRT), der funktionellen Bildgebung und der bildgeführten Navigation ermöglichen heute eine deutlich schnellere und präzisere Planung, Durchführung und Überprüfung neurochirurgischer Eingriffe. Gleichzeitig werden moderne Softwarelösungen zunehmend entlang des gesamten klinischen Workflows eingebunden – von der präoperativen Bildfusion und Segmentierung über die patientenspezifische Trajektorienplanung bis hin zur intra- und postoperativen Kontrolle der Elektrodenlage. Diese Entwicklungen erhöhen die Effizienz und Sicherheit, und eröffnen neue Behandlungsoptionen.
DBS: Softwaregestützt zu mehr Präzision
Die DBS ist eine etablierte Behandlungsmethode für Menschen mit Bewegungsstörungen wie Parkinson, essentieller Tremor und Dystonie, deren Symptome sich medikamentös nicht kontrollieren lassen. Die Methode wird zudem eingesetzt, um bei schwierig zu behandelnder Epilepsie Krampfanfälle zu reduzieren.
Dabei werden Elektroden in bestimmte Bereiche des Gehirns implantiert, um abnormale Impulse zu regulieren oder bestimmte Zellen und Chemikalien zu beeinflussen. Das Ausmaß der Stimulation wird durch ein Schrittmacher-ähnliches Gerät gesteuert, das im oberen Brustbereich unter der Haut der PatientInnen eingesetzt wird. Von dort aus führt ein Draht subkutan zu den Elektroden im Gehirn.
Moderne Technologie hilft ÄrztInnen, den Workflow beim Einsetzen der Elektroden durchgehend zu verbessern. Dies beginnt mit einer 3D-Visualisierung der Patientenanatomie, die es dem klinischen Personal erleichtert, Trajektorien zu planen. Zudem unterstützt Software die Rahmenlokalisierung oder Interfaces mit robotischen Systemen zur Implantierung. Software hilft nicht nur bei der intraoperativen Überprüfung der Elektrodenplatzierung, sondern auch bei der bildgestützten Programmierung und unterstützt so die behandelnden ÄrztInnen bei der Festlegung der optimalen Einstellungen für die DBS. Integrierte klinische Software-Suiten vereinen alle Planungsfunktionen in einer einheitlichen Umgebung. So können ÄrztInnen schnell und unkompliziert auf alle wichtigen Daten zugreifen und Eingriffe leichter und von verschiedenen physischen Standorten aus planen. Die Software ermöglicht Einblicke in die spezifische Anatomie jedes einzelnen Patienten – so lässt sich die Planung zudem spezifisch zuschneiden.
| 3 Fragen zur Tiefen Hirnstimulation: Hirn-OP im Wachzustand? Dank neuester Bildgebung unter Narkose |
|---|
| Lesen Sie passend dazu das Kurz-Interview mit einem Londoner Neurochirurgen. |
Akkurate Planung für optimale Platzierung
Bei der DBS handelt es sich um einen komplexen neurochirurgischen Eingriff, der präzise Planung, Durchführung und Nachsorge erfordert. Der zugehörige chirurgische Workflow umfasst mehrere aufeinander abgestimmte Schritte, die von der präoperativen Bildgebung und Trajektorienplanung über die genaue Platzierung der Elektroden bis hin zur postoperativen Überprüfung und Feinjustierung der Stimulationseinstellungen reichen.
Anatomische Segmentierung unterstützt die Planung eines Eingriffs. Dabei handelt es sich um die automatische Generierung eines anpassungsfähigen Software-Modells der patientenspezifischen Anatomie. Dieses basiert auf der Analyse von Bildgebungsdaten (z. B. CT und MRT), welche von ChirurgInnen überprüft und validiert werden, und ermöglicht es, je nach Modalität eine Vielzahl anatomischer Strukturen zu erkennen. Diese lassen sich in der Software als Objekte erstellen, was eine präzise Behandlungsplanung erleichtert.
Software-Anwendungen wie das bereits in vielen Ländern erhältliche Elements Fibertracking ermöglichen die Erstellung eines Rekonstruktionsmodells von Faserbahnen unter Verwendung entweder deterministischer DTI (Diffusion Tensor Imaging) oder neuerer fortschrittlicher probabilistischer Tracking-Algorithmen, die in 3D visualisierbar sind. Die Anwendung trägt so dazu bei, die weiße Substanz intuitiv, zuverlässig sowie reproduzierbar zu tracken und letztlich eine fundierte Risikobeurteilung von Behandlungsstrategien zu ermöglichen. Ziel ist es, die therapeutischen Ergebnisse zu verbessern und den Erhalt der kognitiven und motorischen Fähigkeiten des Patienten zu gewährleisten.
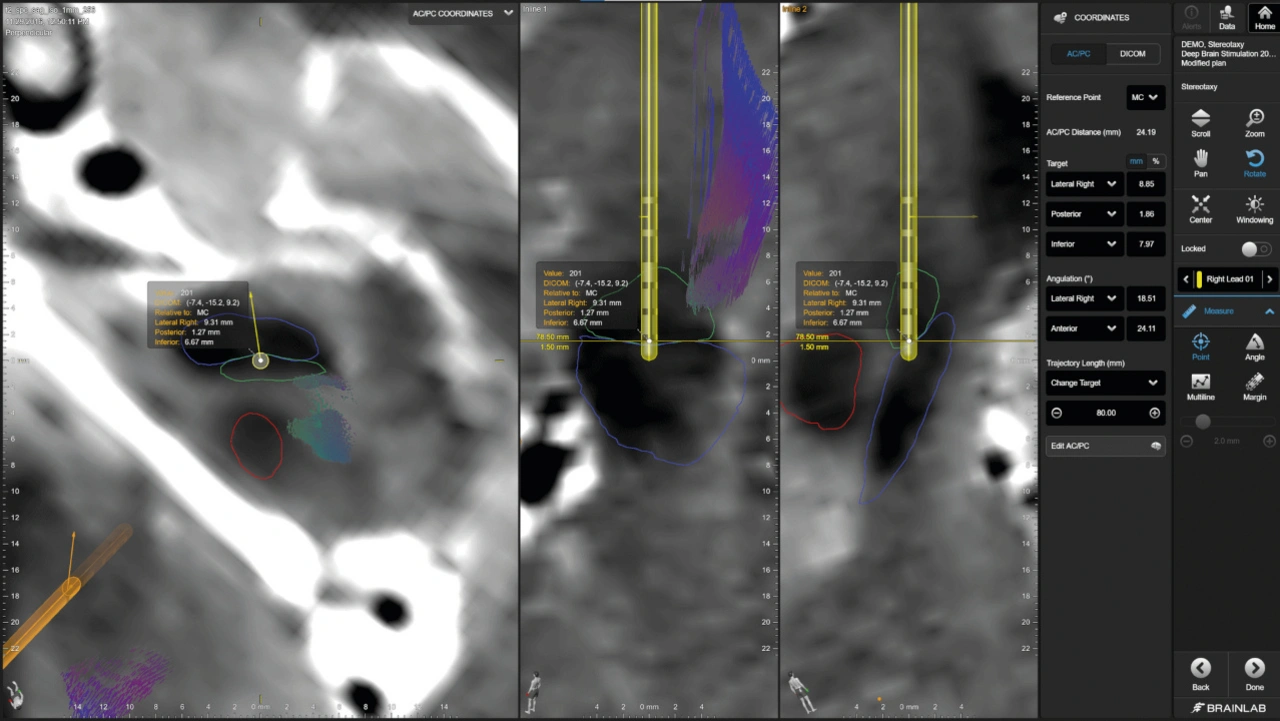
Nachdem ChirurgInnen den Zielbereich im Gehirn als Startpunkt definiert haben, erfolgt die Trajektorienplanung: Mithilfe von 2D- und 3D-Visualisierung sowie flexibler 3D-Elektrodenmodellierung simuliert sie die geplante Trajektorie, um die Sicherheit des Eingriffs zu gewährleisten und mögliche Komplikationen zu minimieren.
Intraoperative Genauigkeit in Echtzeit
Nach Abschluss der präoperativen Planung beginnt der intraoperative Teil des DBS-Verfahrens – ein kritischer Moment, in dem die zuvor virtuell geplante Strategie in die klinische Realität überführt wird. Mobile intraoperative Bildgebungssysteme unterstützen beispielsweise die stereotaktische Rahmenlokalisierung. Spezialisierte Softwarelösungen fusionieren Bilddaten in Echtzeit mit den präoperativ geplanten Modellen. Anhand von entweder intraoperativ aufgenommenen 3D- oder 2D-Aufnahmen können die implantierten Elektroden automatisch visualisiert und als 3D-Elektrodenformen modelliert werden, sodass medizinische Fachkräfte ihre akkurate Positionierung noch während der OP überprüfen können.
Ein weiterer Vorteil softwaregestützter Prozesse: Sie erlauben es, intraoperativ Stimulationseffekte digital zu testen. Die Stimulation einzelner Kontakte kann dabei im Rahmen der Operation direkt mit neurologischen Reaktionen abgeglichen werden – oft unterstützt durch klinische Softwaremodule, die eine objektive Beurteilung der Wirksamkeit ermöglichen und entsprechende Daten in die Dokumentation integrieren.
Datengestützte, postoperative Nachsorge
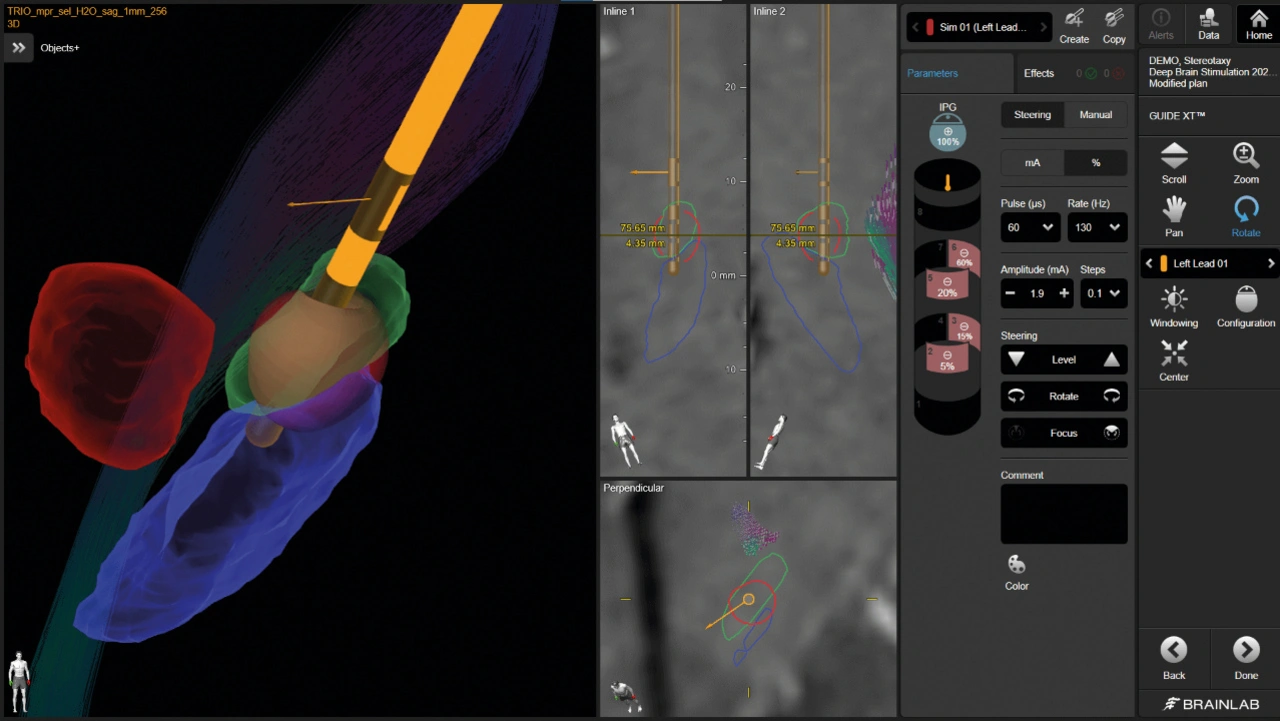
DBS ist keine Einheitslösung, denn jeder Patient reagiert unterschiedlich auf die Stimulation. Daher ist eine individuelle Programmierung der Elektrode unerlässlich. Nach der OP stehen dementsprechend die exakte Dokumentation der Elektrodenlage sowie die individuelle Feineinstellung der Stimulationsparameter an – heute stark von digitalen Tools geprägt.
Spezialisierte Programme ermöglichen die Darstellung der implantierten Elektroden und der damit verbundenen Stimulationsfelder (Volume of Tissue Activated – VTA) in Bezug auf die individuelle Anatomie des Patienten. Dadurch wird sichtbar, welche Areale durch bestimmte Stimulationsparameter beeinflusst werden. Dies kann die Programmierungszeit erheblich verkürzen, da der programmierende Arzt Simulationsparameter sowohl vor der Patientenvisite als auch direkt während des Besuchs planen und so die Stimulationsabdeckung des therapeutischen Zielbereichs maximieren kann. Zudem trägt die präzise Modellierung des Wirkungsbereichs dazu bei, die Wirksamkeit der DBS-Therapie zu maximieren und gleichzeitig kognitive oder motorische Nebenwirkungen zu minimieren.
Digitalisierung als Schlüssel
Moderne Bildgebung und softwaregestützte Prozesse ebnen der funktionellen und stereotaktischen Neurochirurgie den Weg zu erhöhter Genauigkeit, Präzision, Effizienz und Individualisierung. Am Beispiel der DBS zeigt sich, wie digitale Tools den gesamten klinischen Workflow – von der präoperativen Planung über die intraoperative Umsetzung bis hin zur postoperativen Nachsorge – systematisch unterstützen und optimieren. Fortschrittliche Softwarelösungen ermöglichen nicht nur eine akkurate Zielstrukturidentifikation und Trajektorienplanung, sondern auch eine personalisierte Stimulationseinstellung, die sich an der individuellen Anatomie und Reaktion der PatientInnen orientiert. Das eröffnet das Potenzial, therapeutische Ergebnisse zu verbessern, Risiken zu reduzieren und die Belastung für das medizinische Personal wie auch für die PatientInnen deutlich zu verringern. Die Digitalisierung ist somit ein zentraler Treiber für die Weiterentwicklung der funktionellen Neurochirurgie und ebnet den Weg für eine breitere Anwendung und höhere Behandlungsqualität in der Zukunft. (uh)




