Nominierungen für den AMA-Preis
Medizinelektronik ganz groß
Fortsetzung des Artikels von Teil 1
Magnetische Durchflusszytometrie (MRCyte)
Es erfordert einen sehr hohen Analyseaufwand, bei Blutuntersuchungen die für den jeweiligen Fall relevanten „Biomarker“ – Moleküle, Enzyme, Hormone, Gene, Zellen – innerhalb der Riesenzahl von verschiedenen Stoffen, die darin herumschwimmen, zu messen. Nachzuweisen sind insbesondere Proteine; dazu verwendet man Antikörper, die genau auf diese draufpassen – komplementär nach dem Schlüssel-Schloss-Prinzip. Wenn ein solcher Antikörper seine spezifischen Zelloberflächenproteine erkennt, dann hängt er sich daran. Zum Nachweis werden die Antikörper zuvor mit fluoreszierenden Molekülen versehen. Dieses etablierte Verfahren nennt sich optische Fluoreszenz-Durchflusszytometrie (Zytometrie = Zell-Vermessung). Die Zellen werden mit kurzwelligem Licht bestrahlt, der Fluoreszenzstoff gibt daraufhin ein längerwelliges ab. Diejenigen Zellen, die das gesuchte Protein enthalten, leuchten also auf und sind auf optischem Wege erkennbar.
Während eine qualitative Analyse dieser Art noch mit vertretbarem Aufwand machbar ist, zeigt sich eine quantitative dagegen als überaus aufwändig. Sie erfordert sehr hohe Investitionskosten und ist wegen komplizierter manueller Probenvorbereitungsschritte nur von hochqualifiziertem Fachpersonal durchführbar. Damit bleibt sie bisher auf zentrale Großlabors beschränkt und dort auf die normalen Arbeitszeiten. Der Transport der Blutprobe bis dorthin kostet häufig viel Zeit, zelluläre Biomarker sind aber oft nicht stabil. Wenn sie sich während des Transports verändern, kann das zu falschen Diagnosen führen. Was benötigt wird, ist eine Analyse so nah wie irgend möglich am Patienten, damit der Arzt schnelle, sichere Entscheidungen über vorzunehmende Behandlungen treffen kann.
Genau dies verspricht eine neuartige Analysemethode, entwickelt von Dr. Oliver Hayden und seinem Team bei Siemens in Erlangen, Unternehmensbereich Healthcare. Im Rahmen des Verbundprojekts „MRCyte“ wurde eine magnetische Durchflusszytometrie entwickelt. An die für den Nachweis von bestimmten Proteinen verwendeten Antikörper werden hier Nanopartikel aus Eisenoxid oder Ferrit angehängt. Damit lassen sie sich aus dem Flüssigkeitsstrom in Richtung auf einen Magnetfeldsensor herauslenken, der dann darauf reagiert. Hier findet eine hochempfindliche GMR-Halbbrücke von Sensitec Anwendung (gigantischer magnetoresistiver Effekt, wie in den Leseköpfen von Festplattenlaufwerken). Zellen, an denen Antikörper mit der besagten magnetischen Markierung hängen geblieben sind, lassen sich auf diese Weise einzeln zählen. Sie durchlaufen dazu einen fluidischen Kanal, der von einem inhomogenen Magnetfeld durchflossen wird. Im Feldgradienten reichern sich dann diese Zellen auf der Substratoberfläche an und rollen eine nach der anderen über den Sensor (Bild 4). Aus der Laufzeit lassen sich Rückschlüsse auf die Art und die Menge der Zellen ziehen.
Jobangebote+ passend zum Thema
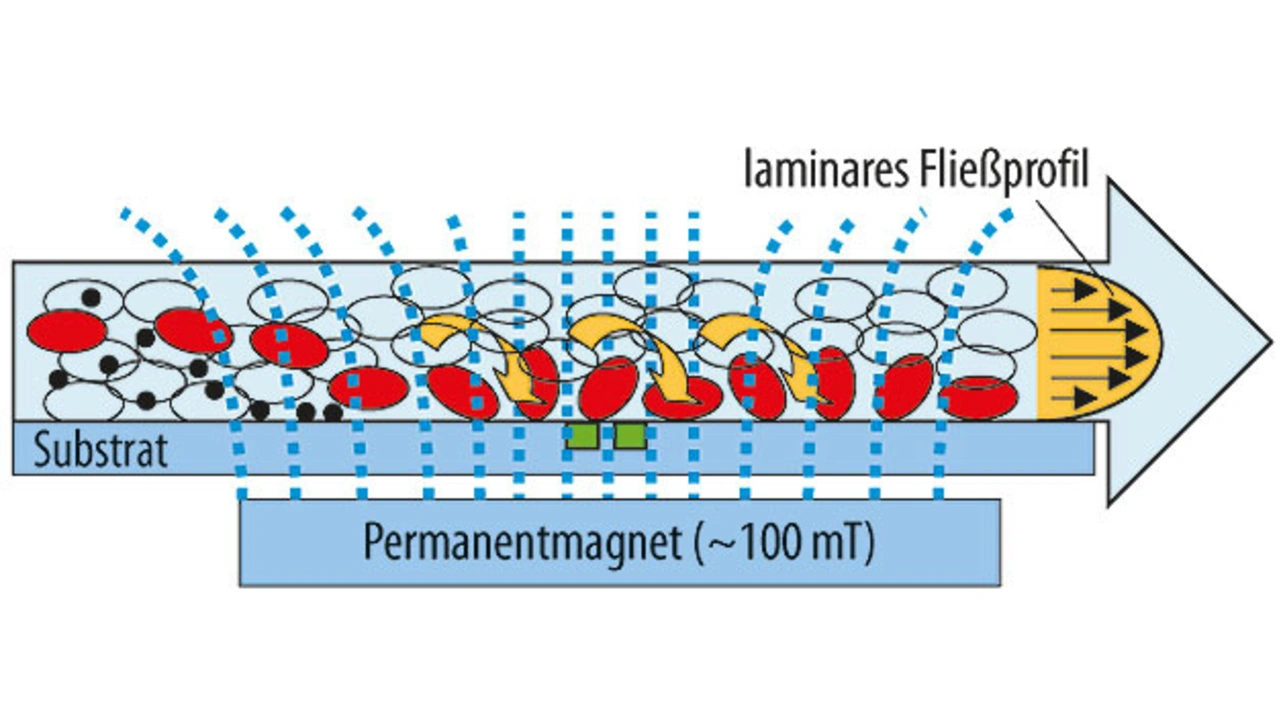
Im Vergleich zur Fluoreszenz-Durchflusszytometrie ist hier keine zeitaufwändige Trennung der Blutbestandteile mehr notwendig, sondern der Vorgang läuft direkt im Vollblut ab, ohne Probenvorbereitungsschritte und damit verbundene Verluste. Das Auswertegerät hat nur noch Schuhkartongröße und ist mit anvisierten Kosten unter 5000 Euro sehr viel preisgünstiger als die herkömmlichen Apparaturen. Es ist auch von ungeschultem Personal bedienbar. Dadurch wird eine Untersuchung in der Nähe des Patienten („Point of Care“) möglich. Ebenfalls kostengünstig sind die Mikrofluidik-Kartuschen, in die die mit Blut befüllte Spritze eingelegt wird, worauf das Blut mit den Markern zusammengebracht und durch feine Kanäle über den GMR-Sensor geleitet wird. Die Analyse läuft innerhalb von wenigen Minuten ab, die Ergebnisse erscheinen auf einem Display.
Nerven aus Glas – Faseroptische 3D-Positionierung von Herzkathetern
Die minimalinvasive Medizin hat in den letzten Jahren große Fortschritte gemacht. Im Gegensatz zu früher sind heute häufig nur noch sehr kleine Öffnungen des Körpers notwendig, durch die der Arzt ein Katheter durch die Venen bis zu der zu untersuchenden Stelle einführt. Wichtig ist dabei, deren aktuelle Position sehr genau zu kennen. Ständige Röntgen-Durchstrahlung des Körpers wäre gefährlich. Andere Systeme für solche Zwecke – Funk oder optische Triangulation – sind störanfällig und kostenintensiv.
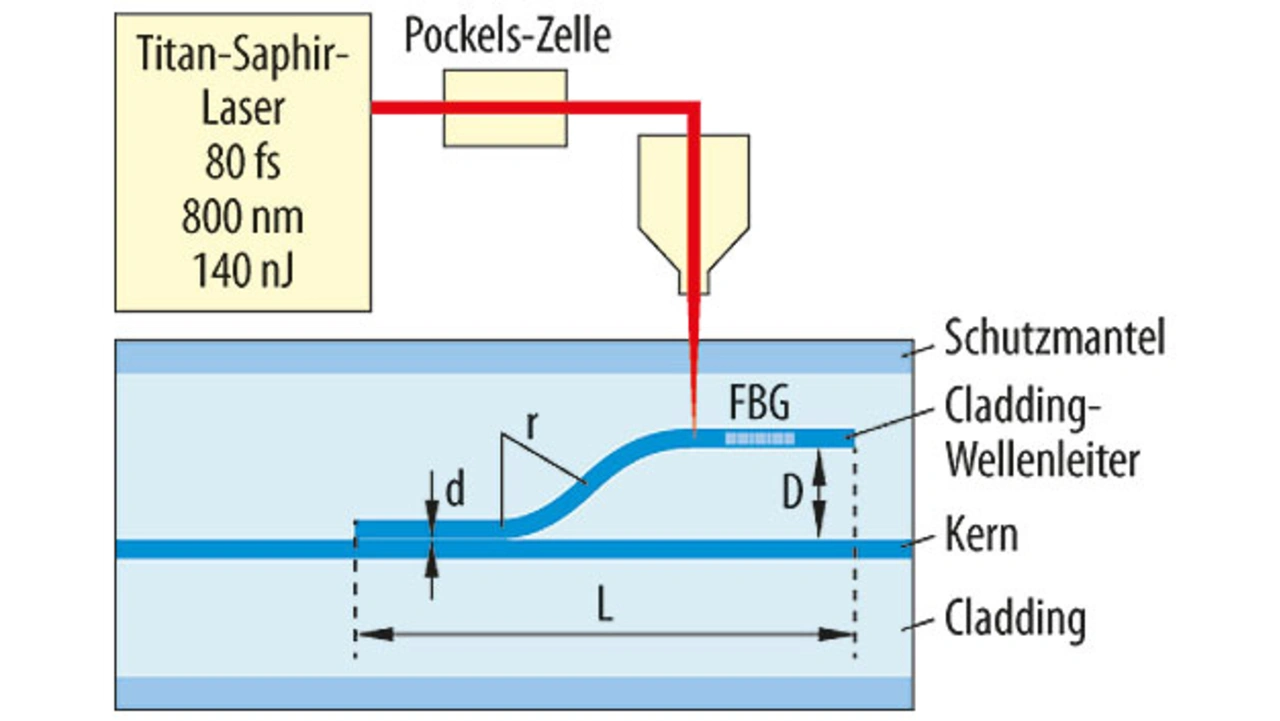
Eine bahnbrechende neue Methode hat Prof. Dr. Wolfgang Schade am Fraunhofer-Heinrich-Hertz-Institut in Goslar entwickelt. Es handelt sich dabei um eine Weiterentwicklung der etablierten Technik des Faser-Bragg-Gitters (FBG). In einem solchen ist der Brechungsindex periodisch etwas höher und niedriger, was durch spezielle Laser-Bestrahlung erreicht wird. Es wird optisch breitbandiges Licht in die Faser eingestrahlt; an jeder Übergangsstelle wird ein kleiner Teil des Lichtes reflektiert. Dabei tritt nur bei der Wellenlänge, die dem Doppelten des Rasters entspricht, konstruktive Überlagerung auf. Diese läuft also zurück und wird mit hoher Auflösung gemessen. Damit sind kleinste Dehnungen und Stauchungen der Faser auf optischem Wege detektierbar. Es lassen sich viele solche Gitter in einer Faser hintereinander anordnen, leicht unterscheidbar durch verschiedene Periodenlängen bzw. reflektierte Wellenlängen. Die erreichbare Messempfindlichkeit liegt unter 10 Mikrostrain (µm/m).
Die neue Idee hier besteht jetzt darin, das FBG nicht im Kern der Faser, sondern im Mantel außerhalb der Mitte zu positionieren. Dies ist in einer Standard-Singlemode-Faser für die Telekommunikation möglich, bei der der Mantel sehr viel dicker als der Kern ist. Mittels eines fs-Lasers werden im Fasermantel außerhalb der Mittellinie zusätzliche „Kerne“ erzeugt, deren Brechungsindex gegenüber der Umgebung geringfügig erhöht ist, mit einem typischen Durchmesser von 5,7 µm. Der Abstand zur neutralen Mittelachse kann zum Beispiel 25 µm sein. In diese werden Faser-Bragg-Gitter eingeschrieben (Bild 5). Wird jetzt die Faser gebogen, dann wird dieser Bereich etwas gedehnt oder gestaucht, was registriert wird. Die Verschiebung der reflektierten Wellenlänge ist dann ein Maß für den lokalen Krümmungsradius.
In eine Faser lassen sich mehrere derartige FBGs einbringen, hier bis zu 15. Da deren Positionen bekannt sind, lässt sich ermitteln, an welcher Stelle die Faser welche Krümmung erleidet – in Stärke und Richtung. Aus den Einzelmesswerten ist dann die dreidimensionale Position des Faserendes, also der Katheterspitze errechenbar – mit einer Genauigkeit unterhalb von 1 mm. Dank des geringen Durchmessers von wenigen Zehntel-mm lässt sich eine solche Faser leicht in übliche Katheter einlegen. Das Ausgangsmaterial ist kostengünstig, die Bearbeitung ebenfalls, wodurch eine Herstellung in Großstückzahlen machbar wird
- Medizinelektronik ganz groß
- Magnetische Durchflusszytometrie (MRCyte)