Batterie-Management
Anforderungen an die Ladestrategie für Bleistarterbatterien
Fortsetzung des Artikels von Teil 1
Alterungsmechanismen
Als Alterung wird bei wieder aufladbaren Energiespeichern das Schwinden ihrer Qualitätsmerkmale während der Betriebszeit bezeichnet. Mit Qualitätsmerkmalen sind Kenngrößen des Speichers gemeint, wie beispielsweise:
- Leistungsfähigkeit und damit die Hochstrombelastbarkeit,
- aktuelle Kapazität, d.h., die unter Nennbedingungen verfügbare Kapazität,
- Ladeakzeptanz, d.h., die Fähigkeit, innerhalb einer definierten Zeit Ladung aufzunehmen,
- Wirkungsgrad, d.h., wieviel von der in den Akku eingebrachten Leistung kann entnommen werden,
- Selbstentladungsrate, d.h., wieviel Ladung verliert der Akku im Leerlauf pro Zeiteinheit.
Die Alterung setzt sich aus kalendarischer und zyklischer Alterung zusammen (Bild 4 ). Ersteres beschreibt den Einfluss der bloßen Lagerung. Im zweiten Fall geht es um den Einfluss des Ladungsdurchsatzes auf die Alterung des elektrochemischen Speichers.
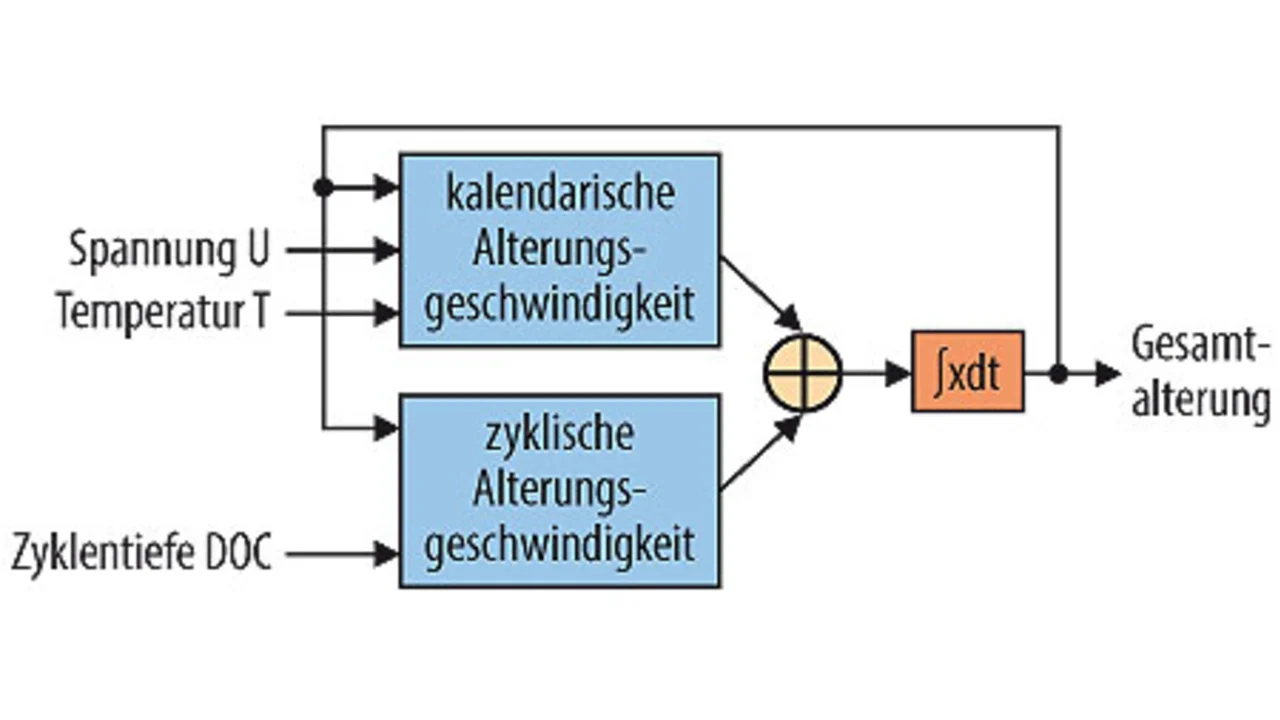
Bereits mit dem Zeitpunkt der Fertigstellung des Energiespeichers setzt die Alterung ein, egal ob dieser verwendet wird oder nicht. Gemäß Bild 4 ist die Alterungsgeschwindigkeit sowohl von der Betriebsführung als auch von der Wahl der technischen Ausführung des Akkus abhängig. Die Auswahl eines nicht geeigneten Akkus impliziert auch eine beschleunigte Alterung. Es ist beispielsweise nicht sinnvoll, eine Starterbatterie in einer unterbrechungsfreien Stromversorgung einzusetzen, denn für die geforderte hohe Kaltstartleistung sind hauchdünne Gitter notwendig, die kaum Korrosionsreserven haben. Binnen kurzer Zeit wären die Gitter durchkorrodiert und die bei USVs üblichen Lebensdauern von ca. 15 bis 20 Jahren völlig illusorisch.
In der Literatur wird Alterung auch als SOH (state of health) bezeichnet und als Verhältnis der aktuellen Kapazität Ca zur Nennkapazität CN definiert. Jedoch sind die beiden Begriffe nicht äquivalent, weil SOH nur ein Spezialfall des Alterungsbegriffes ist.
Für die nun folgenden Betrachtungen ist es sinnvoll, sich sowohl das Phasenschema (Formel 1)
(+) Pb(s)|PbO2(s)|PbSO4(s)|H2SO4(aq, c = (4 − 5)M)|PbSO4(s)|Pb(s) (-)
als auch die Elektrodenreaktionen
Entladen ⇒ Pb(s) + PbO2(s) + 2H+ + 2HSO−4 (aq) D 2PbSO4(s) + 2H2O(l) ⇐ Laden (1)
für die Energieaufnahme und -entnahme des Akkus ins Gedächtnis zu rufen. Aus der Betriebsführung der Starterbatterie ergeben sich spezifische Alterungsmechanismen, vor allem:
- Sulfatierung bzw. Rekristallisation, d.h., Bildung großer Bleisulfatkristalle auf Kosten der Kleineren,
- Säureschichtung, d.h., vertikaler Konzentrationsgradient der Schwefelsäure,
- Zellenschluss, z.B. durch Dendritenbildung.
Sulfatierung - Rekristallisation
Sulfatierung ist die häufigste Alterungserscheinung bei Starterbatterien [7]. Hierbei bilden sich schwerlösliche, elektrochemisch wenig aktive Bleisulfat-Kristalle (PbSO4), die beim Wiederaufladen nur schwer oder nicht vollständig in geladene aktive Masse, also in Bleischwamm (Pb) bzw. poröses Bleidioxid (PbO2) umgewandelt werden können. Dies führt zu einer Kapazitätsminderung und ferner zu einer Erhöhung des Innenwiderstandes, was wiederum eine verminderte Startfähigkeit nach sich zieht. Die negativen Platten des Bleiakkus haben eine größere Tendenz zu sulfatieren als die positiven Elektroden [9]. Eine möglichst hohe Ladeakzeptanz, d.h., die Fähigkeit des Speichers, Ladung und damit Energie aufzunehmen, ist eine wesentliche Anforderung im Automobil und Sulfatierung ist ein Mechanismus von mehreren, welche die Ladeakzeptanz signifikant verschlechtern. Dies ist für die negative Elektrode von Y. Yamaguchi et al. [10] durch morphologische Untersuchungen bewiesen und von M. Thele et.al. [11] mittels rein elektrischer Messmethoden bestätigt worden.
Sulfatierung wird beschleunigt durch folgende Betriebsführung:
- Zyklisieren im PSOC (insbesondere bei Mangelladung),
- Entladung mit kleinen Stromstärken,
- lange Standzeiten im entladenen Zustand und
- hohe Temperaturen.
Im ersten Fall werden die beim Entladen gebildeten Bleisulfatkristalle nicht vollends in aktive Masse umgewandelt. Eine darauffolgende erneute Entladung führt nicht zu neuer Keimbildung, sondern setzt an den bereits vorhandenen PbSO4-Kristallen an, welche somit wachsen. Für den zweiten Fall gilt: Die Bildung von PbSO4 erfordert sowohl Pb2+- als auch SO42-Ionen. Bei kleinen Entladeströmen ist die Konzentration der Pb2+-Ionen im Elektrolyt niedrig, so dass eine Anlagerung an bereits bestehende Kristalle wahrscheinlicher ist, als dass sich genügend viel Blei- und Sulfationen zusammenfinden, um einen neuen Kristall zu bilden. Der dritte und vierte Fall folgt aus der Tatsache, dass die Löslichkeit des Bleisulfats mit sinkender Säuredichte und steigender Temperatur zunimmt (siehe auch Bild 7).
Die schwammige Definition lässt erahnen, dass Sulfatierung bis zu einem gewissen Grad reversibel ist. Es gilt: Je größer die nichtleitenden Bleisulfatkristalle werden, desto schwieriger ist es, sie beim Ladevorgang wieder in aktive Masse zu konvertieren. Diese Bedingung ist hinreichend, aber nicht notwendig, denn es gibt auch sulfatierte Elektroden, deren Sulfatkristalle klein sind [12].

Demzufolge ist davon auszugehen, dass die elektrochemische Aktivität von PbSO4 nicht nur auf dessen Größe allein zurückzuführen ist. Morphologische Untersuchungen von Y. Yamaguchi et al. an der negativen Platte ergaben, dass es zwei Arten von Bleisulfatkristallen gibt.
Eine Variante wird auf chemischem Wege, mit glatter Oberfläche, und eine zweite Variante auf elektrochemischem Wege, mit rauer Oberfläche, gebildet (Bild 5). Eine glatte Oberfläche impliziert eine niedrigere Oberflächenenergie und höhere Festigkeit, so dass die auf chemischem Wege gebildeten Bleisulfatkristalle beim Laden schwieriger abgebaut werden können als jene mit rauer Oberfläche.
![Sulfatierungsmodell nach [12]: Von den elektrochemisch gebildeten PbSO4-Kristallen (Entladen) lösen sich im Leerlaufbetrieb Pb2+-Ionen im Elektrolyten Sulfatierungsmodell nach [12]: Von den elektrochemisch gebildeten PbSO4-Kristallen (Entladen) lösen sich im Leerlaufbetrieb Pb2+-Ionen im Elektrolyten](https://cdn.elektroniknet.de/thumbs/media_uploads/images/1386838967-105-bild-6.jpg.1280x0.webp)
Aufgrund dieser Beobachtung schlugen Yamaguchi und Koautoren ein neues Sulfatierungsmodell vor (Bild 6).
Zu ähnlichen Erkenntnissen sind M. Thele et al. in [11, 13] durch rein elektrische Messungen gekommen.Aufgrund der Tatsache, dass die Ladeakzeptanz eines geladenen Bleiakkus bei flacher Zyklisierung mit der Zeit zunimmt, folgerten sie, dass sich jüngere Bleisulfatkristalle leichter in aktive Masse konvertieren lassen als ältere.
Es bilden sich demnach sogenannte verhärtete Bleisulfatkristalle mit niedriger elektrochemischer Aktivität.
- Anforderungen an die Ladestrategie für Bleistarterbatterien
- Alterungsmechanismen
- Säureschichtung
- Einfluss der Gitter
- Einfluss der Ladestrategie
- Literatur und Autor




