Body-Gateway-Plattform
Der Patient im Netz (2)
Sogenannte Telehealth-Verfahren sind vielversprechend, jedoch komplex zu implementieren. Die Grundlagen zu Sensoren, Signalaufbereitung und Verarbeitungsplattformen wurden in der MEDIZIN+elektronik 05/2012 dargelegt, im Folgenden folgt eine experimentelle Auswertung nebst konkreten Anwendungsmöglichkeiten.
Wie in [1] dargelegt, wurden für die EKG-Signalaufbereitung zwei verschiedene Verarbeitungsketten implementiert und evaluiert: die Hamilton-Tompkins-Kette [2,3] mit einem allgemein verfügbaren Algorithmus zur Abschätzung der Herzfrequenz (OSEA) und eine Pan-Tompkins-Kette für den Prototyp des Body-Gateways. Die ersten Versuchsergebnisse zeigten zwei kritische Situationen.
Im einen Fall wurde die Verbindung zur Elektrode getrennt, und im anderen Fall reichte das Rauschen in die Bandbreite des interessierenden Signals hinein. Beides führt zu einer falschen Erkennung von Spitzen in der R-Welle mit einer daraus resultierenden fehlerhaften Bestimmung der Herzfrequenz. Der Algorithmus wurde daraufhin auf dreierlei Weise verbessert:
Zum ersten lassen sich durch Evaluierung der Signalvarianz kritische Ereignisse erkennen (zum Beispiel Verlust der Elektrodenverbindung, hochfrequentes Rauschen), weil die Varianz des Signals während solcher Ereignisse wesentlich größer ist. Die zweite Verbesserung beruht auf der Berechnung der Ähnlichkeit zu einer als Vorlage dienenden Referenzwelle.
Die Ähnlichkeit wird durch Ermittlung lokaler Minima der Summe der absoluten Differenzen (SAD) zwischen dem jeweiligen Abschnitt des Signalverlaufs und der Vorlage bestimmt [4]. Zum Abschluss dient ein Muster-Datenbestand dazu, den Algorithmus von der erfassten Wellenform unabhängig zu machen. Dies ist notwendig, da die Funktionsfähigkeit des Prototyps von der Platzierung der Elektroden unabhängig sein muss.

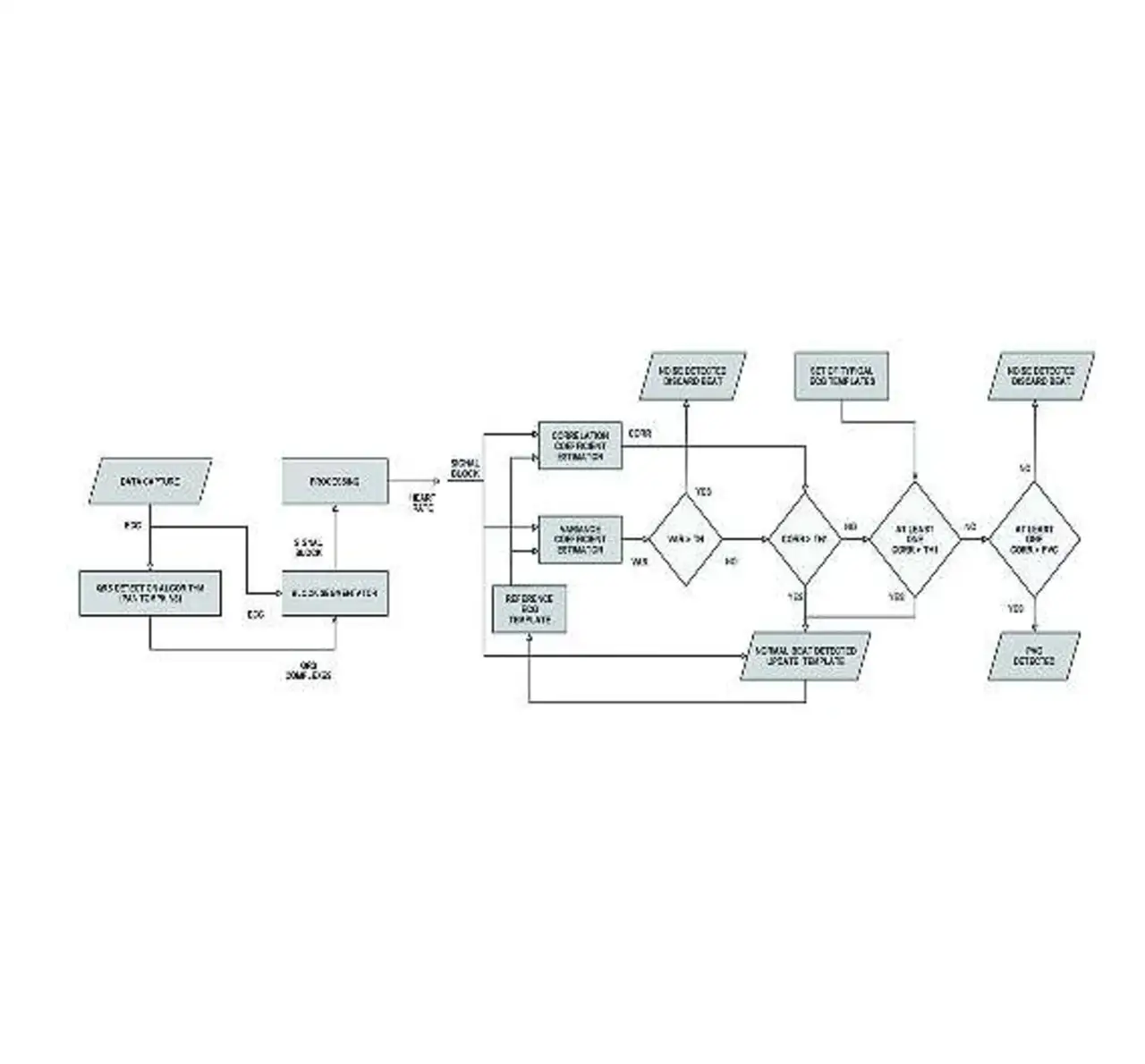
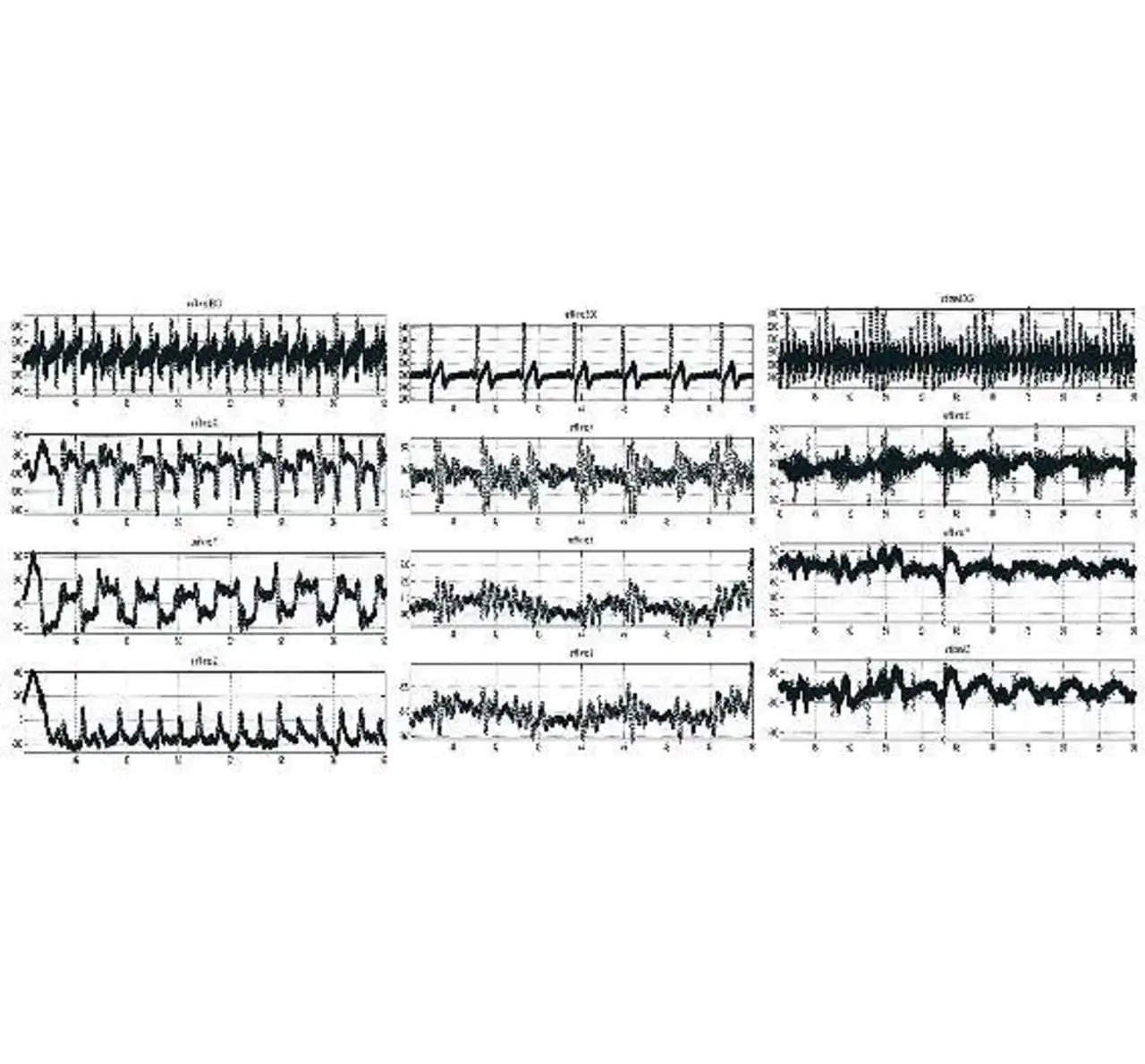
Die Vorlagen werden entsprechend den erkannten Mustern aktualisiert, um das System an das spezifische EKG-Profil des jeweiligen Patienten anzupassen. Die Erkennungslogik ist in Bild 1 zu sehen, während Bild 2 sowohl die Vorlagen als auch die Verarbeitungsresultate wiedergibt.
Signalaufbereitung
Das vom Beschleunigungssensor ausgegebene Signal wird gefiltert und aufbereitet. Ziel ist die Extraktion eines Parameters, der Auskunft über die Gesamtaktivität des Patienten und die Lage des Körpers gibt. Der erste Schritt besteht in der Abschätzung des Schwerkraftvektors. Die Signale der einzelnen Achsen werden zunächst tiefpassgefiltert, was über ein langes Zeitintervall einen einfachen Mittelwert liefert.
Die Komponenten des Schwerkraftvektors werden anschließend als Quadratsummen berechnet, was den Betrag der Schwerkraft ergibt. Die gleichen Daten der drei Achsen dienen außerdem zum Abschätzen des Betrags des Vektors. Eine mathematische Operation auf der Basis von Betrag und Richtung der Schwerkraft erlaubt die Berechnung eines Aktivitätsniveaus. Dabei handelt es sich um einen Index, der auf einen Bereich von 0 (keine Aktivität) bis 63 (maximale Aktivität) normalisiert wird.
Um die Körperposition des Patienten abschätzen zu können, nimmt der Algorithmus als Erstes eine Selbstkalibrierung vor. Diese wird angestoßen, sobald das Aktivitätsniveau einen bestimmten Grenzwert übersteigt. Grundlage hierfür ist die Prämisse, dass ein hohes Aktivitätsniveau (Gehen, Laufen) nur in vertikaler Position möglich ist. Um die per Selbstkalibrierung vorgenommene Schätzung weiter zu verfeinern, lässt sich die Lage des Körpers auch durch externe Kalibrierung ermitteln.
Der Algorithmus kann dazu einen externen Input erhalten, der die nur wenige Sekunden andauernde Kalibrierung anstößt. Während dieses kurzen Intervalls muss sich der Patient in vertikaler Position ruhig verhalten, damit die Abschätzung des Vektors für diese Lage verfeinert werden kann. Der Schwerkraftvektor für die vertikale Position wird anschließend gemittelt und abgespeichert. Damit lässt sich die Körperposition während der Verwendung des Body-Gateways abschätzen.
Möglich sind die Positionen Stehen, Sitzen oder Liegen. Ergänzend zum den obigen Aussagen lassen sich Herz- und Atemfrequenz auch aus dem Beschleunigungssensor-Signal abschätzen (Bild 3, Mitte und rechts). Tatsächlich kann der Beschleunigungssensor schwache Signale mit Frequenzen unter 150 Hz detektieren, was gute Voraussetzungen für eine Mechanomyografie und ein zufriedenstellendes Phonokardiogramm bietet.
Nachteilig ist, dass diese Art der Erfassung nur dann möglich ist, wenn sich der Patient nicht bewegt. Die Atemfrequenz lässt sich ebenfalls aus dem EKG-Signal extrahieren, und zwar durch Ermitteln der Hüllkurve der Spitzen in der R-Welle (Bild 3, rechts).
Verarbeitung des Bioimpedanzsignals
Das Body-Gateway verwendet die transthorakale Bioimpedanz als Indikator für die Atmung. Da Impedanzänderungen nicht nur durch das Bewegen thorakaler Strukturen (und dadurch bedingte Änderungen der Distanz zwischen den Elektroden) hervorgerufen werden, sondern auch durch das wechselnde Luftvolumen in den Lungen [5], ergibt dies eine aussagefähigere Information als die schlichte Auswertung von Bewegungen der Brust.
Insbesondere können Frequenz und Tiefe der Atemzüge überwacht werden. Dies ist wichtig, denn bekanntermaßen ist langsames und tiefes Atmen effizienter als schnelles und flaches Atmen. Das Prinzip der Bioimpedanzmessung besteht darin, einen Wechselstrom in den Körper einzuleiten, dessen Frequenz über 10 kHz liegt, um jegliche Interferenzen mit den elektrischen Aktivitäten der Nerven und des Muskelgewebes zu vermeiden, und dabei den Spannungsabfall zwischen zwei Punkten zu messen.
Es sind Messungen mit zwei und vier Elektroden möglich. In der hier vorliegenden Version wurde eine Lösung mit vier Elektroden gewählt, da die Abschätzung der basalen Impedanz hierbei mit größerer Zuverlässigkeit möglich ist als bei Verwendung von zwei Elektroden. Besonderheiten des Bioimpedanz-signals sind das Vorhandensein einer Herzschlag-Komponente (dies ist die Quelle von Artefakten aus der Perspektive der Atmungsüberwachung) und die gute Korrelation des Signals mit dem tatsächlich eingeatmeten Luftvolumen [5].
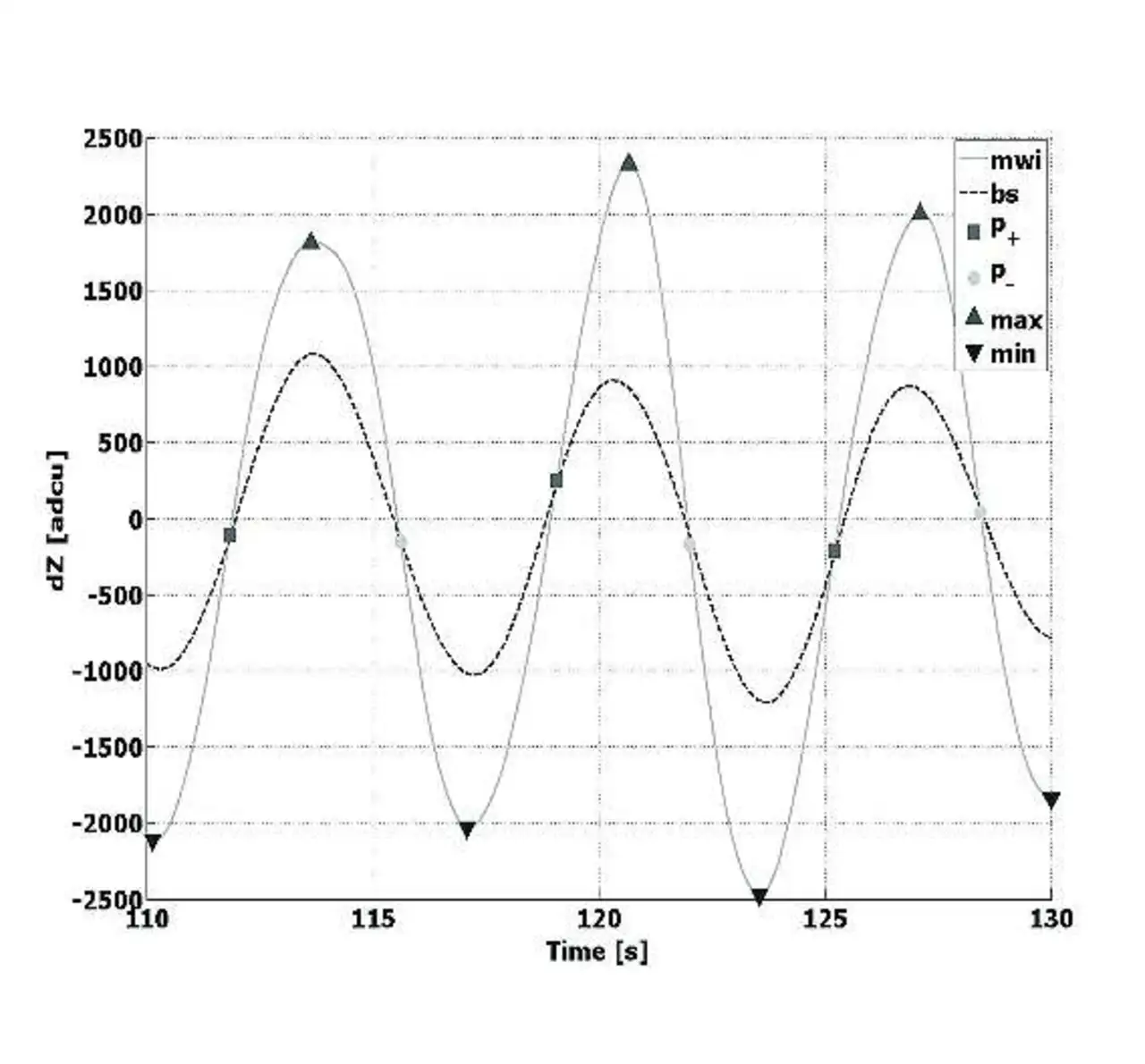
Unter Berücksichtigung dieser Aspekte wurde ein Algorithmus entwickelt und geprüft, der die Atemfrequenz eines Patienten zuverlässig in Echtzeit abschätzt. Hauptmerkmal dieses Algorithmus‘ ist der sehr geringe Rechenaufwand, der ihn auch für am Körper tragbare Geräte mit ihren begrenzten Ressourcen geeignet macht. Im Unterschied zu vielen anderen physiologischen Signalen weist das Bioimpedanzsignal keine spezifische Morphologie auf, wie es beispielsweise beim EKG mit dem PQRST-Komplex der Fall ist.
Die Erkennung der Atmungsvorgänge kann sich deshalb nicht auf die Identifikation bestimmter Muster im erfassten Signal stützen. Ein typischer Atmungsvorgang resultiert vielmehr in einer langsamen, mit hoher Ampli-tude erfolgenden Veränderung des Bioimpedanzsignals. Zum Abschätzen der Atemfrequenz ist deshalb keine hohe Abtastrate erforderlich.
Der typische oszillierende Anteil von Atmungsvorgängen ist nämlich von extrem niedriger Frequenz. Tatsächlich liegt die Atemfrequenz eines ruhenden Erwachsenen zwischen zwölf und 20 Atmungsvorgängen pro Minute und beträgt auch bei Sportlern bei anstrengenden Übungen selten mehr als 40 Atemzüge pro Minute. Das ideale Spektrum für die Atmung erstreckt sich somit von 0,1 Hz bis 1,0 Hz.
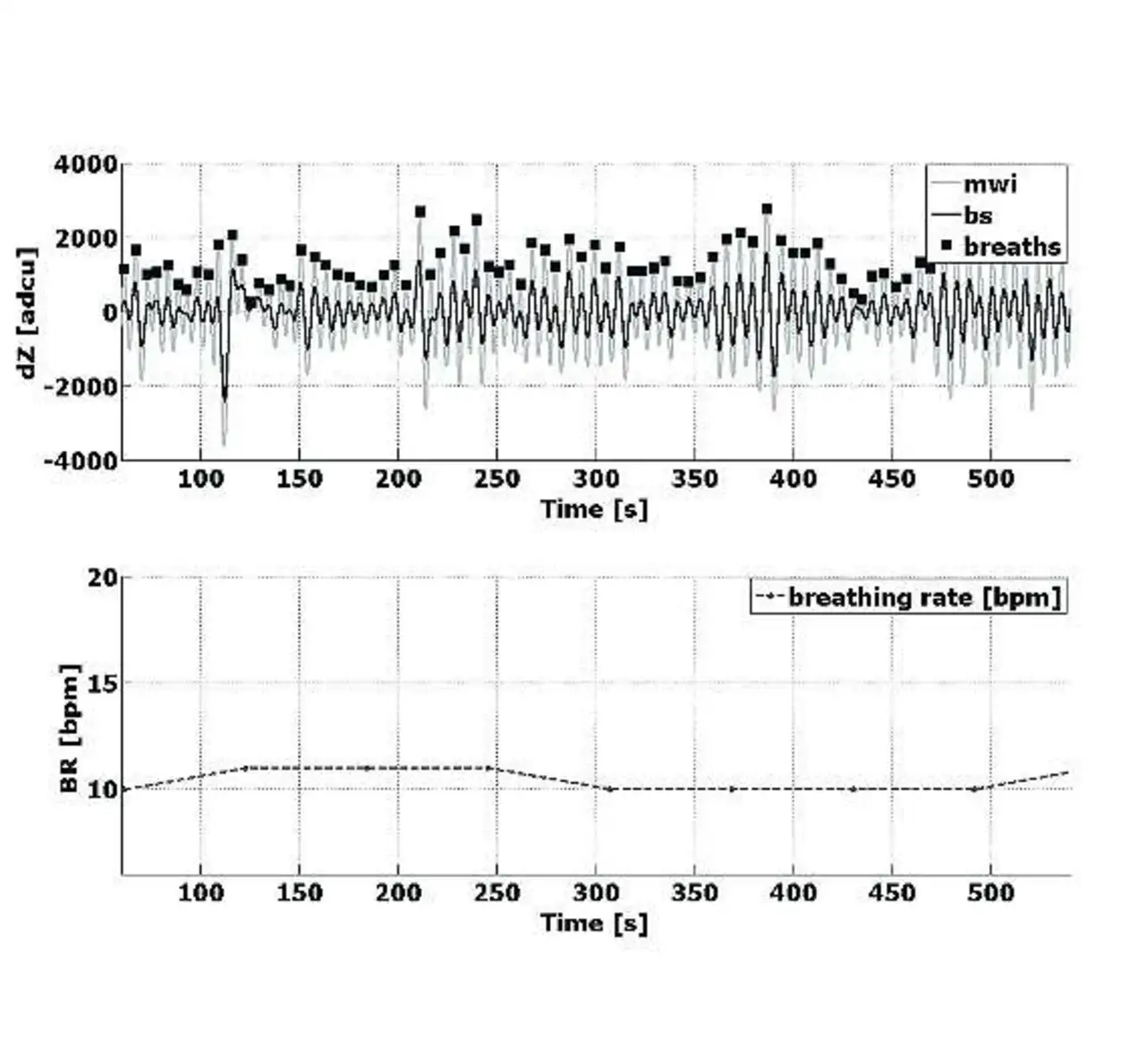
Der Algorithmus wurde für eine Abtastfrequenz von 32 Hz ausgelegt, ist jedoch bei geringfügiger Anpassung der Filterkette auch für andere Abtast-raten geeignet. Positive und negative Spitzen in der sinusähnlichen Atmungskurve treten in der Regel am Ende des Ein- und Ausatmens auf. Das Detektieren dieser Peaks macht es möglich, die Atmungsvorgänge effizient zu erfassen und zu zählen.
Da überdies nachgewiesen werden kann, dass die Peak-to-Peak-Amplitude mit der Tiefe der Atemzüge korreliert, erweist sich eine Atmungs-erkennungs-Strategie, welche die Signalamplitude einbezieht, als höchst zuverlässig. Bleibt ein kleiner Atemzug unentdeckt, ist der daraus resultierende Fehler nur von geringer Tragweite, da ein solcher Atmungsvorgang im Kontext des gesamten Atemmechanismus meist von geringer Effizienz ist. Die Bilder 4 und 5 geben einige Ergebnisse des Atemfrequenz-Algorithmus‘ wieder.
Gemeinsame Verarbeitung
Im Anschluss an die unabhängige Verarbeitung lässt sich die Genauig-keit der Signale verbessern, indem die gleichen, aber von einem anderen Sensor aufgezeichneten Signale gemeinsam verarbeitet werden. Diese Signalfusion ist Gegenstand von Forschungs- und Entwickungsaktivitäten derjenigen Abteilung von ST, die auch an der Entwicklung der Body-Gateway-Plattform arbeitet.
Es ist etwa möglich, ein und denselben Parameter aus Signalen abzu-schätzen, die mit verschiedenen Sensoren erfasst wurden. Dieses Zusammenführen von Signalen aus unterschiedlichen Kanälen ergibt zuverlässigere Aussagen. Zum Beispiel wird die Herzfrequenz primär mithilfe des Elektrokardiogramms bestimmt. Untermauern lässt sich das Signal jedoch mit den Resultaten, die sich aus der Photoplethysmographie oder dem akustischen Signal ergeben.
Bei ruhendem Patienten liefert darüber hinaus auch das Signal des Beschleunigungssensors sinnvolle Aussagen. Ähnlich ist es mit der Atemfrequenz, die in erster Linie aus dem Bioimpedanzsignal bestimmt wird, während das Photoplethysmographie-Signal ebenfalls eine Schätzung ermöglicht. Auch hier aber können das Mikrofonsignal und (bei ruhendem Patienten) der Beschleunigungsaufnehmer unterstützende Informationen liefern.
Ein weiteres Forschungsgebiet zielt auf die Verbesserung der Signalqualität. Da mehrere Parameter verfügbar sind, lassen sich diese kombinieren, um verlässlichere Informationen zu extrahieren oder sogar eine neue Information hervorzubringen. Zum Beispiel wird das Photoplethysmographie-Signal durch Störartefakte beeinträchtigt, die sich mithilfe des Beschleunigungssensors abschätzen lassen.
Das System ist nun in der Lage, diese Artefakte in Echtzeit zu kompensieren, um eine zuverlässigere Information bereitzustellen. Auf die gleiche Weise wird die aus dem EKG extrahierte Herzfrequenz mit der physischen Aktivität verglichen, die mithilfe des Beschleunigungssensors bestimmt wird. Dabei ist zwischen anormalen Situationen (Tachykardie bei ruhendem Körper) und normalen Zuständen (hohe Herzfrequenz während des Laufens) zu unterscheiden.
Das Body-Gateway ist für die Verwendung durch Medizinpersonal vorgesehen, das in der Anfangsphase die Aufgabe hat, in unterschiedlichen Situationen (in Ruhe, beim Gehen oder beim Laufen) eine Reihe von Parametern korrekt zu erfassen. In dieser Phase erlernt die Software die typischen Wellenformen und typischen Werte der verschiedenen Parameter in den einzelnen Situationen. Das Gerät kann sich somit auf den jeweiligen Patienten einstellen.
Im Anschluss daran schaltet die Software auf permanente Überwachung um und zeichnet die aus der Aufbereitung hervorgehenden Parameter auf. Bei etwaigen anormalen Ereignissen zeichnet das Gerät sowohl die extrahierten Parameter als auch die Rohsignale auf, damit diese für eine spätere Untersuchung verfügbar sind. Über eine drahtlose Verbindung erfasst die Software ferner periodisch Signale von anderen Geräten (beispielsweise von einer elektronischen Waage) und übermittelt die Verarbeitungsergebnisse an einen zentralen Server. Das Gerät wurde von Anfang an für die Realisierung von Fernüberwachungs-geräten konzipiert.
Erforschung stromsparender Techniken
Extrem stromsparende Basistechnologien und Mikroprozessoren sind eine entscheidende Grundlage für viele neue Anwendungen, zu denen am Körper tragbare oder implantierbare biomedizinische Sensoren gehören. Die ersten Implementierungen dieser Micropower-Prozessoren basierten meist auf kleinen (8 Bit oder 16 Bit), dabei aber weitgehend optimierten Architekturen mit einer Energieeffizienz von wenigen Picojoule pro Zyklus, indem sie mit der Transistor-Schwellenspannung (VT) oder darunter arbeiteten.
Spätere Designs brachten es auf höhere Verarbeitungsleistung. Zu diesem Zweck kamen entweder Hardwarebeschleuniger zum Einsatz, die eigens für eine bestimmte Anwendung ausgelegt waren, oder man verwendete allgemeine Algorithmen, die in vielen Anwendungen Verwendung fanden. Neue Anwendungen geben den Anstoß zur Verwendung größerer Architekturen mit dem Vorteil größerer Adressbereiche, höherer Datengenauigkeit und besserem Betriebssystem-Support.
ST arbeitet an einem 32-Bit-Mikroprozessor-System-on-Chip (SoC), das einerseits bei maximaler Betriebsspannung eine hohe Spitzen-Performance (82,5 MHz bei 1,2 V) erzielen soll und sich andererseits bei geringer Betriebsspannung durch extreme Energieeffizienz (10,8 pJ bei 0,6 V) unter Beibehaltung von Taktfrequenzen über 1 MHz auszeichnen soll. Um den Betrieb mit sehr geringen Spannungen zu ermöglichen, ist das SoC mit einem internen Speicher aus eigens hergestellten 8T-SRAMs ausgestattet.
Die Leistungsaufnahme des Speichersystems wurde durch die Verwendung miniaturisierter, latchbasierter Befehls- und Daten-Caches verringert, die nicht für hohe Geschwindigkeit, sondern für geringe Zugriffsenergie optimiert wurden. Weitere Features, die dazu beitragen, das Ganze zu einem kompakten, eigenständigen System zu machen, sind chipinterne Takterzeugungsfunktionen, ein in den Chip integrierter A/D-Wandler sowie eine Standardausstattung mit Peripherie wie beispielsweise Timern und seriellen Schnittstellen.
Implementiert wurde das SoC mit dem 65-nm-CMOS-Prozess von ST. Die Gesamtperformance des Chips wurde mit einer Reihe von Benchmark-Programmen evaluiert, die so ausgewählt wurden, dass sie repräsentativ für jene Algorithmen sind, die das SoC beispielsweise in einer medizinischen Sensorapplikation ausführen müsste. Da der Stromverbrauch der Speicher entscheidenden Anteil am Stromverbrauch des Gesamtsystems hat, lassen sich mit dem Design einer effizienten Niedervolt-Speicher-architektur deutliche Verbesserungen erzielen. Die Entwickler haben mit diesem Design die Effektivität von Befehls- und Daten-Caches nachgewiesen, die trotz geringer Speicherkapazität auf erhebliche Trefferquoten kommen und die Gesamt-Leistungsaufnahme um nahezu 20% verringern können.
Über die Autoren:
Akikatsu Kamiya ist Director, Mariateresa Gatti ist Director of Research und Innovation in der Advanced System Technology Organization, beide bei STMicroelectronics.
| Bibliografie |
|
|---|---|
| [1] |
A. Kamiya, M. Gatti: »Der Patient im Netz(1)«, http://www.medizin-und-elektronik.de/mobile-medizintechnik/article/92753/0/Der_Patient_im_Netz_1/ |
| [2] | B.-U. Kohler, C. Hennig and R. Orglmeister, »The principles of software QRS detection«, IEEE Eng. Med. Biol. Mag., vol. 21, pp. 42-57, Jan./Feb. 2002. |
| [3] | P. S. Hamilton and W. Tompkins, »Qantitative Investigation of QRS detection rules using the MIT/BIH arhytmia database«, IEEE Trans Biomed. Eng., vol. BME-33, pp. 1157-1165, Dec. 1986. |
| [4] | S. E. Dobbs, N. M. Schmitt and H. S. Ozemek, »QRS detection by template matching using real-time correlation on a microcomputer«, J. Clinic. Eng., vol 9, pp. 197-212, 1984. |
| [5] |
L. E. Baker (1989a), »Applications of the impedance technique to the respiratory system«, IEEE Engineeering in Medicine And Biology Magazine, 8(1):50-52. |