EN 60601-1 3rd Edition
Verbesserter Patientenschutz
35 Jahre nachdem die legendäre UL/EN 60601 den weltweiten Standard für die Sicherheit in der Medizintechnik setzte, sorgt die 3rd Edition durch zusätzliche Auflagen für noch besseren Patientenschutz. Auf Seiten der Hersteller hält sich die Begeisterung in Grenzen, zumal nun eine Risikoabschätzung Teil des Zertifizierungsprozesses ist. Dies erfordert schon in der Entwicklungsphase eine enge Zusammenarbeit mit dem Prüflabor.
Seit ziemlich genau einem Jahr ist nun die 3rd Edition der EN 60601-1 in Europa bindend. Während sich im Bereich der elektrischen Spezifikationen wenig geändert hat, müssen Hersteller von medizinischem Gerät zukünftig einen Risikomanagementprozess implementieren, der dem Modell der ISO 14971 folgt. Dadurch ist es erforderlich, neben der Einhaltung fundamentaler technischer Standards nun auch spezifische Prozesse zu dokumentieren und einzuhalten. Durfte gemäß den Vorgaben der 2nd Edition ein Gerät während der Tests noch kaputt gehen, solange die Sicherheit von Patient und Bedienpersonal gesichert war, so fordert die neue Version der Norm nun zusätzlich, dass die »essenzielle Funktionalität« des Systems erhalten bleibt. Diese muss in einem sogenannten »Risk Management File« (RMF) dokumentiert sein.
Da Erkenntnisse aus dem Prüflabor ins RMF-Dokument einfließen müssen, ist nun eine weit engere Zusammenarbeit zwischen Hersteller und Prüflabor erforderlich, wodurch sich die Entwicklungszeit verlängern kann.
Recht unzufrieden sind europäische Hersteller mit den regionalen Kompromissen zugunsten der USA. Das eine Jahr Verspätung, mit der die Norm in Amerika im Juli 2013 in Kraft tritt, können die meisten Unternehmen noch verschmerzen. Allerdings empfinden sie die Tatsache als schwerwiegenden Wettbewerbsnachteil, dass in Europa - anders als in den USA - auch neue Produkte älterer Bauart betroffen sind. Dies führt dazu, dass die Unternehmen in jedem Einzelfall abwägen müssen, ob sich ein Redesign lohnt oder ob sie nicht besser das alte Gerät vom Markt nehmen und durch eine Neuentwicklung ersetzen. Dieser kurzfristige Nachteil kann aber mittel- und langfristig zum Vorteil werden, weil europäische Hersteller gezwungen sind, früher mit Neuentwicklungen auf dem Markt zu sein und letztlich über konkurrenzfähigere Produkte verfügen werden.
Interessant ist, dass die 3rd Edition der UL/EN 60601 Unterschiede macht zwischen der Sicherheit für Patient und Personal. Für Geräte und Systeme, die nicht in Kontakt mit dem Patienten kommen (MOOP, Means of Operator Protection), sind reduzierte Luft- und Kriechstrecken ausreichend, wie sie in der EN 60950-1 für »normale« elektronische Ausrüstungen definiert sind. Dies ist vernünftig und kann als Erleichterung gesehen werden.
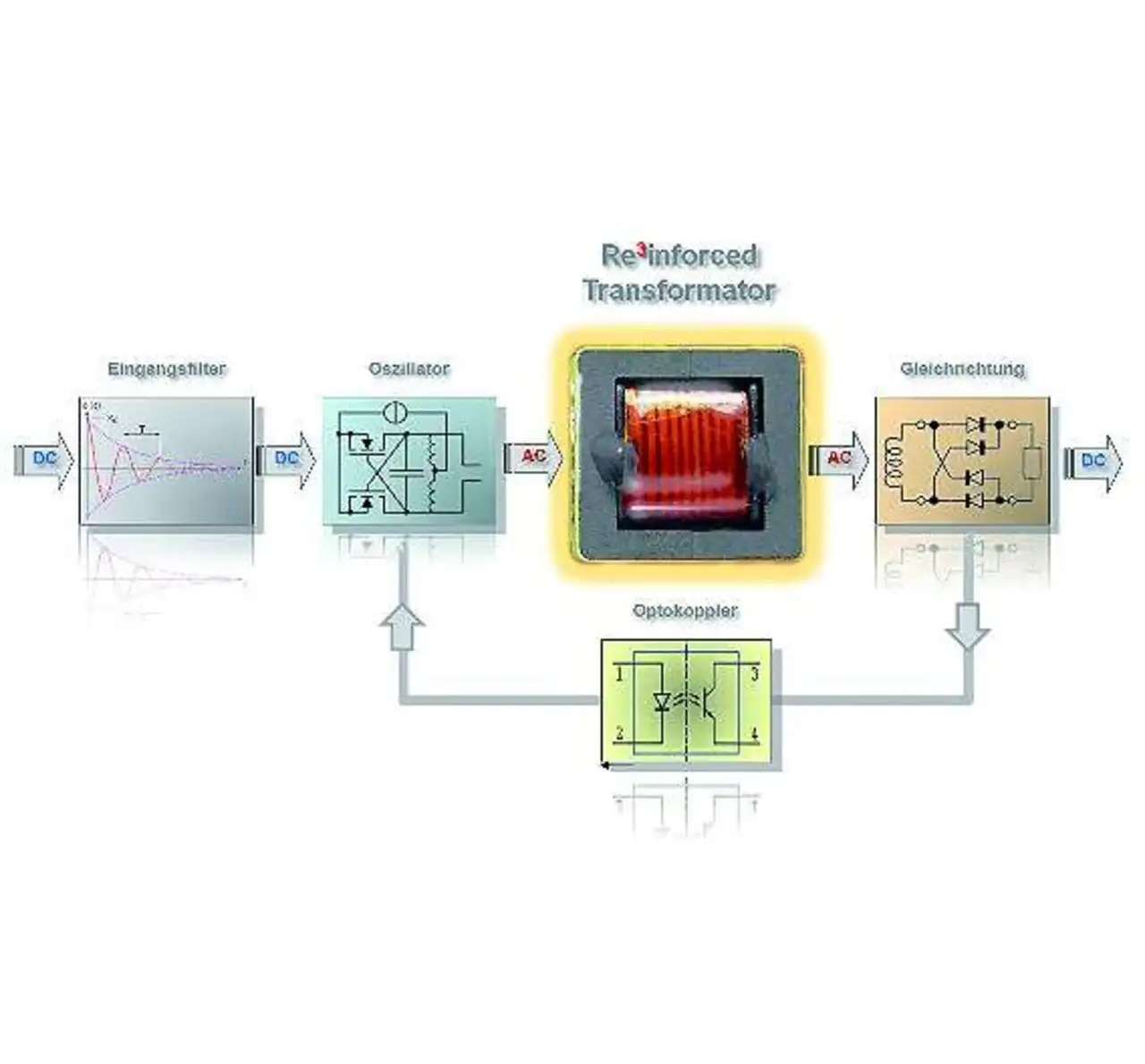
Da aber zugleich die Forderung nach sehr niedrigen Ableitströmen aus der EN 60601 erfüllt sein muss, sind Hersteller oft besser beraten, auch hierfür »reinforced« isolierte DC/DC-Wandler einzusetzen, wie sie bei Geräten mit Patientenkontakt (MOPP, Means of Patient Protection) als zweite Isolationsbarriere vorgeschrieben sind. Diese Barriere isoliert die Medizinelektronik im Inneren des Systems von Diagnosegeräten wie Magensonde, Endoskop oder EKG-Elektroden (Bild 1). Die erste Isolationsbarriere auf der Versorgungsseite wird wie bisher schon durch ein »medizinisches« Netzteil realisiert.
Neue Trafo-Technologie verbessert Wirkungsgrad
Die Luft- und Kriechstrecken im Trafo von reinforced isolierten DC/DC-Wandlern müssen rund dreimal größer sein, als dies zum Beispiel für elektronische Bürogeräte vorgeschrieben ist. Hierfür hat man bislang die Primär- und Sekundärwicklung des Trafos getrennt voneinander auf entgegengesetzte Hälften eines Ringkerns gewickelt. Mit der räumlichen Trennung war das Problem »Isolation« gelöst, gleichzeitig wurden aber auch die beiden Magnetfelder voneinander getrennt, mit einigen unerwünschten Nebenwirkungen für die Leistungsfähigkeit des Trafos. Da sich die beiden Magnetfelder nicht mehr optimal überlagern können, sinkt der Wirkungsgrad. Dadurch steigen die Wärmeverluste im Trafo und damit die Betriebstemperatur. Beides würde man zu gerne vermeiden, da hohe Effizienz und knapp bemessene Energiebudgets bei Neuentwicklungen im Pflichtenheft stehen.
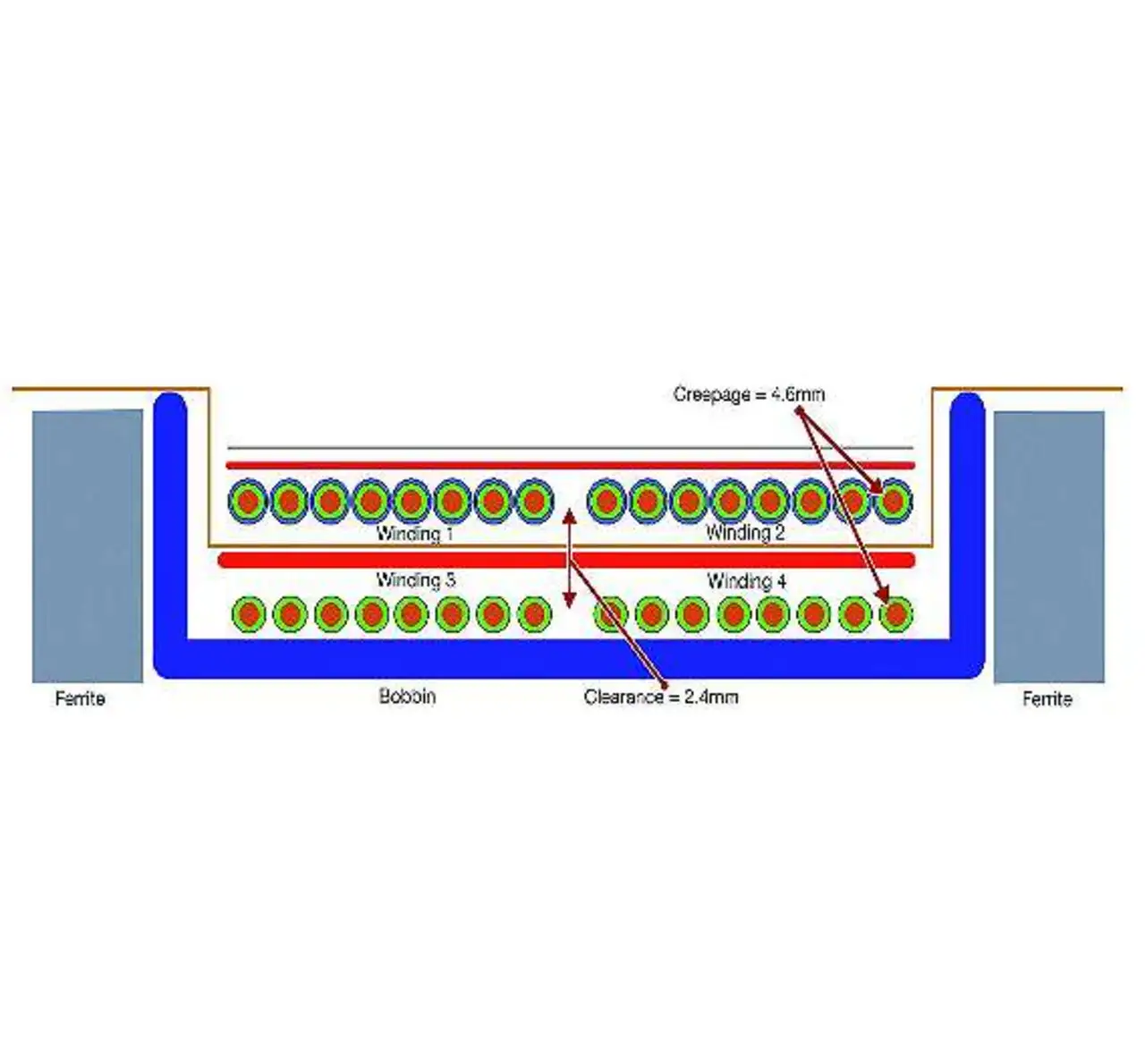
Ingenieure von Recom ist es gelungen, ein neuartiges Trafokonzept zu realisieren. Dabei sind die Primär- und Sekundärwicklung so ineinander verzahnt, dass die für reinforced Isolation vorgeschriebenen Luft- und Kriechstrecken eingehalten werden und die Magnetfelder sich nahezu optimal überlappen (Bild 2). Durch eine quasiresonante Schaltungstopologie erzielen die neuen Wandler 15% bis 20% mehr Leistung im selben Gehäuse und sind aufgrund der geringeren Wärmeverluste für Umgebungstemperaturen bis +85 °C zugelassen, im Gegensatz zu den rund +70 °C, die bei Wandlern mit konventionellem Ringkern-Trafo üblich sind. Gleichzeitig konnte die Wicklungskapazität auf Werte von wenigen Picofarad reduziert werden. Dies sorgt für niedrigere Ableitströme, wie sie in der Medizinelektronik erwünscht sind.
Recom bietet ein umfangreiches Programm an medizinischen Wandlermodulen, die entsprechend der 3rd Edition für direkten Patientenkontakt zertifiziert sind. Die Serien »Rxx/Pxx« und »Rxx/P2xx« decken die 1-W- und 2-W-Klasse ab und sind in einem SIP7-Kleingehäuse lieferbar. Die 2-W-Version gibt es als »RV«-Serie auch im DIP24-Gehäuse, um pinkompatibel zu älteren Designs zu sein. Die Serien »REC3.5« und »REC6« leisten 3,5 W beziehungsweise 6 W und verfügen ebenfalls über ein DIP24-Gehäuse. Die genannten Modelle sind mit Isolationsspannungen bis 8 kV (DC) bzw. 10 kV (DC) lieferbar.
Neben den reinforced isolierten Modellen gibt es eine Reihe weiterer Produktfamilien, die für den Einsatz in medizinischen Applikationen ohne Patientenkontakt (MOOP) zertifiziert sind. Es handelt sich dabei um geregelte und ungeregelte SMD-Wandler mit Nennleistungen von 0,25 W bis 2 W (»RxS«-Familie) sowie um mehrere unterschiedliche Wandlerserien.
Über den Autor:
Reinhard Zimmermann ist Produkt Marketing Manager bei Recom Electronic.