STED-Mikroskopie
Live-Bilder aus dem Mäusehirn
Unmengen an Informationen werden tagtäglich nicht nur über unsere Datenautobahnen verschickt. Auch unser Gehirn muss eine riesige Datenflut verarbeiten. Dazu steht jede der rund hundert Milliarden Nervenzellen mit tausenden Nachbarzellen in Kontakt. Diese winzigen Strukturen sind nur schwer sichtbar zu machen, besonders während sie aktiv sind - doch nur so lässt sich ihre Funktionsweise entschlüsseln. Die STED-Mikroskopie eröffnet Neurobiologen und Medizinern neue Wege, grundlegende Vorgänge im Gehirn zu entschlüsseln.
Der gesamte Datenaustausch im Gehirn erfolgt über Kontaktstellen, die Synapsen. Nur wenn Nervenzellen zur richtigen Zeit und am richtigen Ort über solche Kontaktstellen miteinander kommunizieren, kann das Gehirn seine komplexen Aufgaben bewältigen: Wir spielen ein schwieriges Klavierstück, lernen jonglieren oder erinnern uns an Namen von Menschen, die wir jahrelang nicht gesehen haben. Am meisten lässt sich über diese wichtigen Schaltstellen im Gehirn lernen, wenn man sie direkt bei ihrer Arbeit beobachtet.
Wann und wo bilden sich neue Synapsen und warum verschwinden sie an anderer Stelle? Keine leichten Fragen, denn Details in lebenden Nervenzellen können nur mit Lichtmikroskopen beobachtet werden. Feinheiten, die enger beieinander liegen als 200 Nanometer, erscheinen aufgrund der Lichtbeugung als ein einziger verwaschener Fleck.
Die von Stefan Hell und seinem Team am Max-Planck-Institut für biophysikalische Chemie entwickelte STED-Mikroskopie (Stimulated Emission Depletion) hat diese Grenze erstmals radikal unterlaufen. Dazu verwenden die Forscher einen einfachen Trick: Eng benachbarte Details werden unter Verwendung eines speziellen Lichtstrahls sequenziell dunkel gehalten, sodass sie nicht auf einmal, sondern nacheinander aufleuchten und somit unterschieden werden können. Mit dieser Technik konnten die Wissenschaftler um Hell die Auflösung gegenüber herkömmlichen Lichtmikroskopen bis um etwa das Zehnfache steigern.
Wie funktioniert STED?

Ein STED-Mikroskop ist ein Fluoreszenzmikroskop, dessen Auflösung nicht beugungsbegrenzt ist und das nach dem RESOLFT-Prinzip (Reversible Saturable Optical (Fluorescence) Transitions) arbeitet. Es wurde 1994 von Stefan Hell theoretisch beschrieben und 1999 experimentell realisiert. Seitdem wird es unter anderem in seiner Arbeitsgruppe am Max-Planck-Institut für biophysikalische Chemie in Göttingen weiterentwickelt; bei Leica wird es mit Gläsern von Schott hergestellt (Bild 1).
Die Auflösung herkömmlicher Fernfeldmikroskope ist aufgrund von Beugung begrenzt. Es lassen sich daher keine Details auflösen, die kleiner als circa die halbe Wellenlänge des verwendeten Lichts sind. Konfokalmikroskope können also nebeneinanderliegende Strukturen nur bis zu einer Größe von etwa 200 nm auflösen. Die Auflösung für hintereinanderliegende Objekte (Tiefenauflösung) ist deutlich schlechter.
Beim STED-Mikroskop wird durch gezieltes Ausschalten von Fluoreszenzfarbstoffen die Auflösung über die Beugungsgrenze hinaus gesteigert. Es konnte bereits eine laterale Auflösung von 5,8 nm gezeigt werden. Für die Untersuchung in einem derartigen Mikroskop werden Fluoreszenzfarbstoffe an bestimmte Stellen des zu untersuchenden Präparats gebracht. Das Beleuchten des Präparats mit Licht geeigneter Wellenlänge regt die Farbstoffe zur Fluoreszenz an, sodass ein Bild der Farbstoffverteilung im Präparat entsteht.
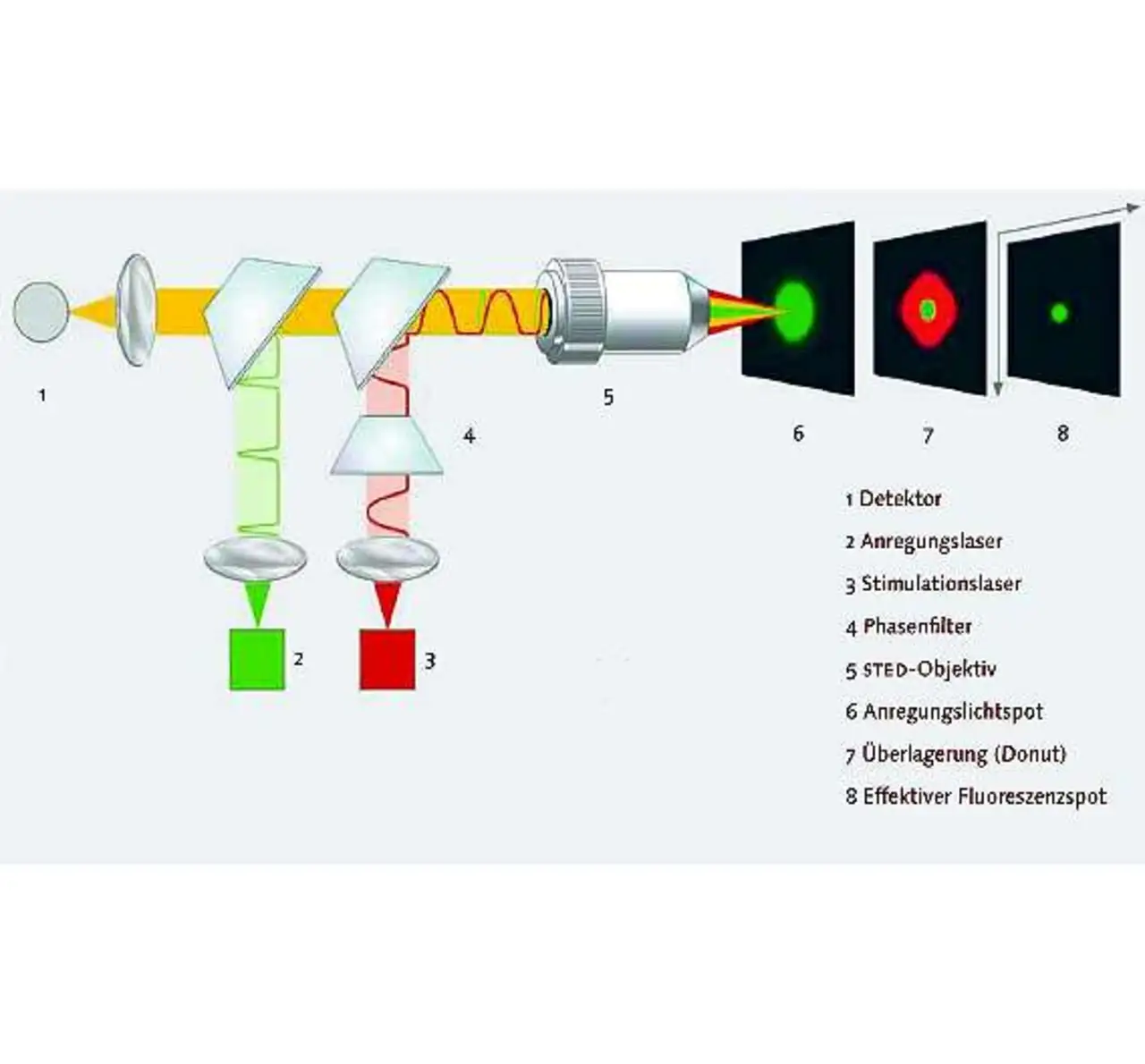
Beim STED-Prinzip ist der Bereich, von dem die Fluoreszenz ausgeht, bedeutend kleiner als der Bereich, den der Laserstrahl beleuchtet (Bild 2). Das lässt sich durch gezieltes Ausschalten der Farbstoffmoleküle im Außenbereich des Fokus‘ erreichen. Dazu wird das Präparat nicht nur mit dem fokussierten Anregungsstrahl beleuchtet, sondern gleichzeitig mit einem zweiten Laserstrahl, dem »Ausschaltestrahl«. Dieser Ausschaltestrahl erhält im Fokus ein ringförmiges Profil.
In der Mitte, also dort, wo der Anregungsstrahl seine maximale Helligkeit hat, ist der Ausschaltestrahl vollkommen dunkel. Dieser Strahl beeinflusst dementsprechend die Fluoreszenzfarbstoffe in der Mitte nicht. Er schaltet aber die Fluoreszenzfarbstoffe im Außenbereich des Anregungsfokus‘ durch stimulierte Emission aus; die Farbstoffmoleküle im Außenbereich bleiben dunkel, obwohl sie von dem Anregungslaser beleuchtet werden. Es leuchten deshalb nur die Farbstoffmoleküle genau aus dem Zentrum.
Hat der Ausschaltestrahl eine hohe Intensität, ist dieser Bereich sehr viel kleiner als der mit dem Anregungslaser beleuchtete Bereich. Beim Scannen des Präparates erfasst man somit jeweils einen leuchtenden Fleck, der viel kleiner ist als in einem normalen Laser-Raster-Mikroskop. Deshalb lassen sich feinere Details auflösen. Um ein vollständiges Bild zu erhalten, wird das Präparat Punkt für Punkt abgerastert.
Die Größe des resultierenden Lichtflecks sinkt mit steigender Intensität des Ausschaltestrahls immer mehr ab. Das bedeutet, dass die Auflösung immer mehr ansteigt, je heller der Ausschaltestrahl ist. Prinzipiell gibt es keine Grenze mehr für die erreichbare Auflösung. Besonders interessant ist, dass die Beobachtung dynamischer Prozesse möglich ist (Bild 3).
Leben unter der Lupe
Die STED-Mikroskopie hat von der Materialforschung bis hin zur Zellbiologie bereits breite Anwendung gefunden. Zellkulturen und Schnittpräparate boten unter diesem Mikroskop faszinierende Einblicke in den zellulären Nanokosmos. Erste Echtzeit-Videoclips von einer Nervenzelle zeigten, wie winzige Botenstoffbehälter innerhalb der langen Nervenzell-Endigungen wandern. Als kühne Vision galt noch vor einem Jahr, was den Physikern und Biologen um Hell nun gelungen ist: auch höhere lebende Organismen mit Detailschärfe im Nanometerbereich zu untersuchen.
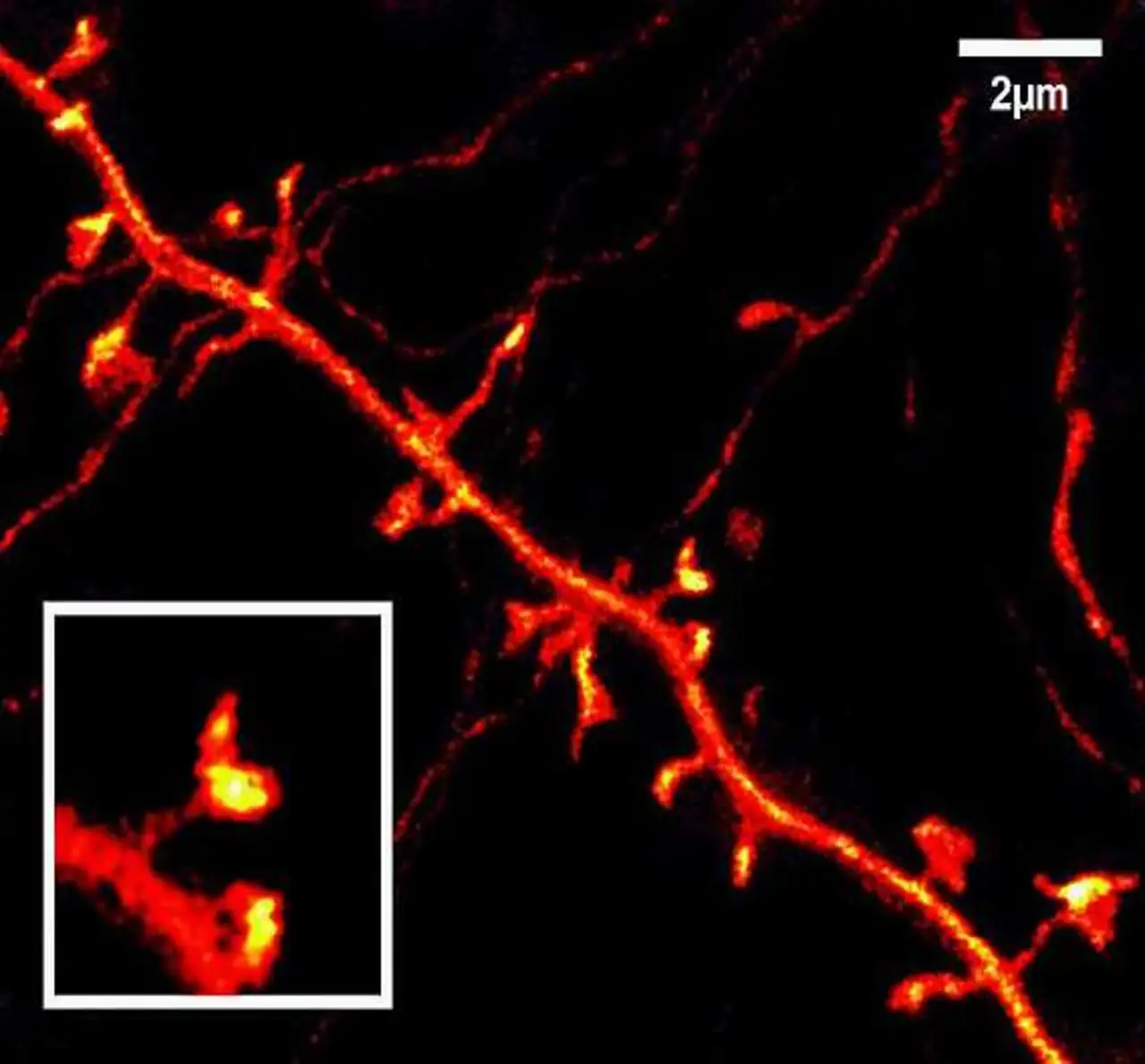
Als erste blickten die Göttinger Forscher mit dem STED-Mikroskop direkt in das Gehirn lebender Mäuse. Ihre Arbeiten zeigen Nervenzellen aus der oberen Hirnschicht der Nager in bisher unerreichter Detailtreue (Bild 3). Es sind die bislang schärfsten Aufnahmen dieser elementaren Kontaktstellen des Gehirnschaltkreises. »Um diese sichtbar zu machen, nehmen wir genetisch veränderte Mäuse, die in ihren Nervenzellen große Mengen eines gelb fluoreszierenden Proteins herstellen. Dieses Protein wandert in alle Verästelungen der Nervenzelle, selbst in kleinste, feinste Strukturen«, erklärt Katrin Willig, Nachwuchsforscherin in der Abteilung NanoBiophotonik von Stefan Hell.
Die genetisch veränderten Mäuse stammen aus einer Zucht der Arbeitsgruppe von Frank Kirchhoff am Göttinger Max-Planck-Institut für experimentelle Medizin. Bilder der Nervenzellen im Abstand von sieben bis acht Minuten offenbarten den Wissenschaftlern Überraschendes: Die Dornfortsätze können sich bewegen und ändern ihre Form. »Die superscharfen Live-Aufnahmen könnten in Zukunft sogar zeigen, wie bestimmte Proteine an den Kontaktstellen verteilt sind«, so Hell. Mit solchen immer detaillierteren Bildern von Strukturen im Gehirn will das Team dazu beitragen, den Aufbau und die Funktion der Synapsen auf molekularer Ebene aufzuklären.
Solche Erkenntnisse könnten auch helfen, Krankheiten besser zu verstehen, die auf einer Fehlfunktion von Synapsen beruhen. Zu diesen sogenannten Synaptopathien zählen beispielsweise Autismus oder Epilepsie. »Durch die STED-Technik und ihre Anwendung im lebenden Organismus bekommen wir nun zum ersten Mal einen optischen Zugang zur molekularen Skala solcher Krankheiten«, hofft Hell.
Als einer der beiden Sprecher des Göttinger DFG-Forschungszentrums Molekularphysiologie des Gehirns setzt er bei seiner weiteren Forschung auf Zusammenarbeit. Mit Neurobiologen und Neurologen möchte er mit seinem Team die Fortschritte in der Abbildungstechnik in grundlegende Erkenntnisse über die Arbeitsweise unseres Gehirns umsetzen.