Medical-Engineering-Prozesse optimieren
Fit für ISO 13485
Viele Medizintechnik-Dienstleiter streben eine Zertifizierung gemäß DIN EN ISO 13485 an, müssen dafür vor allem ihre eigenen Prozesse überprüfen und anpassen – und dürfen dabei den Aufwand für Gap-Analysen, Prozessoptimierung und das eigentliche Zertifizierungsaudit nicht unterschätzen. Ein Erfahrungsbericht.
Durchführung und Dokumentation von Entwicklungsprojekten im Bereich Medizintechnik stellen Software- und Gerätehersteller vor große Herausforderungen. Dabei kommt dem kontinuierlichen Qualitätsmanagement eine Schlüsselrolle zu. Die Norm »DIN EN ISO 13485 (:2012), Medizinprodukte – Qualitätsmanagementsysteme – Anforderungen für regulatorische Zwecke« (im folgenden Text: ISO 13485) enthält die Anforderungen an das Qualitätsmanagement für Medizinproduktehersteller.
Damit ein Medizingerät in Deutschland verkauft werden darf, muss es das Medizinproduktegesetz (MPG) einhalten. Dieses wiederum basiert auf europaweit geltenden Bestimmungen. Hierbei gibt es drei Direktiven für unterschiedliche Geräteklassen. Setzt ein Hersteller die Vorgaben der ISO 13485 um, dann kann davon ausgegangen werden, dass sein Qualitätsmanagement mit dem geltenden Recht konform ist. Die Konformität des QM-Systems mit den regulatorischen Anforderungen wird durch eine Benannte Stelle geprüft und mit einem Zertifikat bestätigt.
Medizintechnikhersteller nehmen heute vielfach die Unterstützung externer Berater in Anspruch. Diese Dienstleister entwickeln im Kundenauftrag auch die in den Medizingeräten enthaltene Software. Dabei kommen meist kundeneigene Prozesse zum Einsatz. Beratungsunternehmen entwickeln jedoch auch eigene Prozesse, um eine hohe Qualität ihrer Dienstleistungen sicherzustellen. Diese müssen den Anforderungen der Medizintechniknormen genauso standhalten wie die Entwicklungsprozesse der Hersteller. Damit sie den steigenden Qualitätsansprüchen der Branche genügen, lassen immer mehr Dienstleister ihr Qualitäts¬managementsystem und die damit verbundenen Prozesse nach ISO 13485 zertifizieren (Siehe Bild).
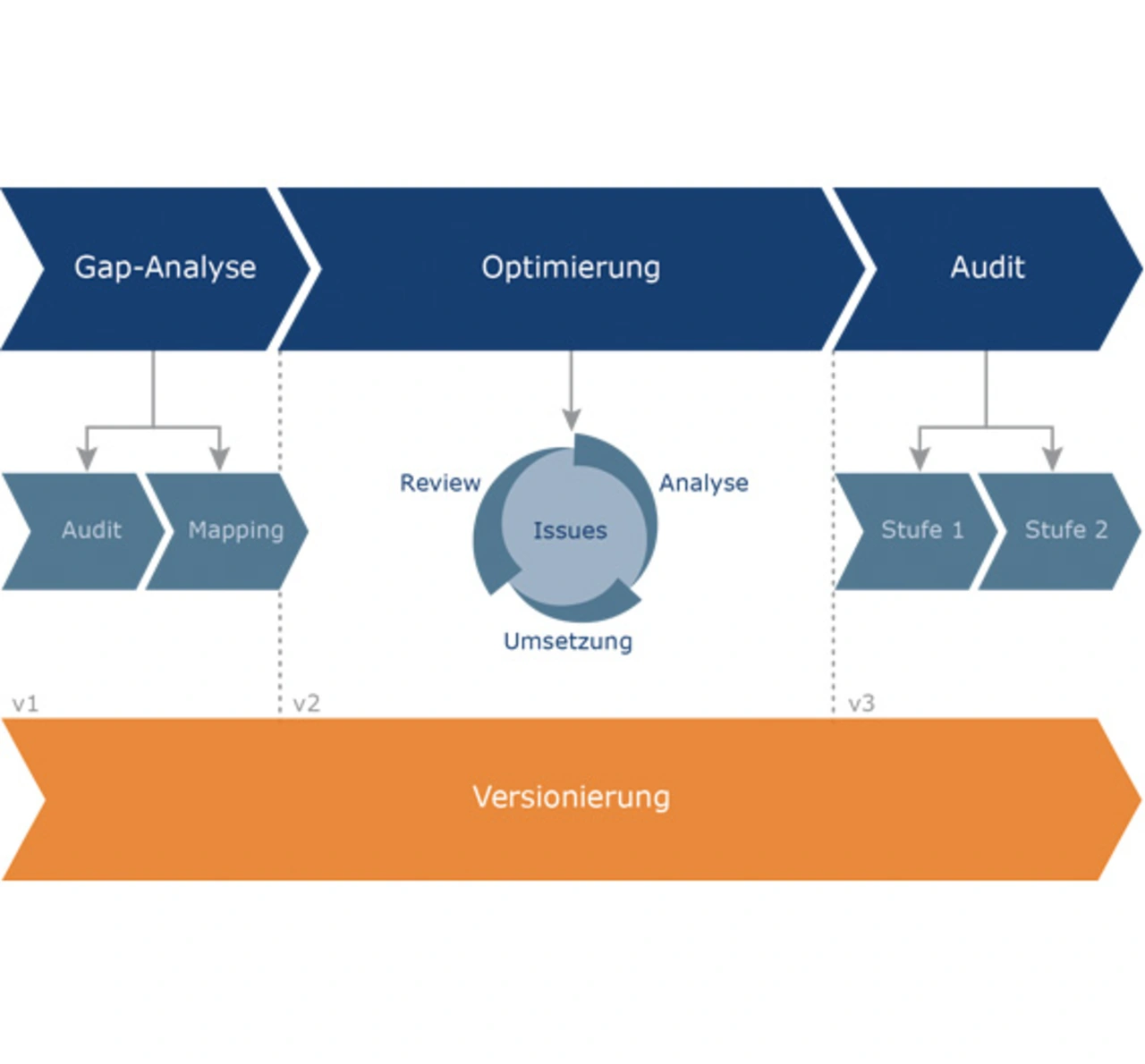
Ein solcher Dienstleister ist auch Method Park in Erlangen. Dieses Beratungsunternehmen verfügt über einen Standardprozess für Software-Entwicklungsprojekte. Dieser »Standard Engineering Prozess« (kurz SEP) deckt verschiedene, für die Entwicklung von Software notwendige Bereiche ab. Die einzelnen Prozessteile sind in logische, sich ergänzende Module gegliedert. Eine besondere Stellung hat hier der sogenannte »SEP.Core«. Dieser ist für jedes Projekt zwingend erforderlich und enthält die notwendige Basis an Aktivitäten, Dokumenten und Rollen für die Projektdurchführung. Er beinhaltet organisatorische Aktivitäten (zum Beispiel Zeiterfassung), Projekt- und Qualitätsmanagement sowie Änderungs- und Konfigurationsmanagement. Die Entwicklungsprozesse befinden sich im sogenannten »SEP.Dev«, der den SEP.Core um die Inhalte Requirements-Management, Softwarearchitektur und -design, Implementierung sowie Release-, Test- und Zulieferermanagement erweitert. Durch Kombination und zusätzliches Tailoring ist es so möglich, den Prozess auf unterschiedlichste Projekte zuzuschneiden. Die Handhabung in realen Projekten ermöglicht das Prozessmanagementsystem »Stages«. Alle Prozesse von Method Park werden in Stages verwaltet. Projekte lassen sich hier anlegen und durch die instanziierten Prozessmodelle steuern.
Diese Prozesslandschaft war Anfang 2013 Basis für eine Zertifizierung nach ISO 13485. Der SEP war ursprünglich nach den Vorgaben der ISO 9001:2008 gestaltet worden. Für eine normkonforme Entwicklung im medizinischen Bereich war er jedoch nicht ausgelegt. Dafür benötigte Verfahren, wie etwa das Risikomanagement oder die Tool-Validierung, waren nicht Bestandteil der Method-Park-Prozesse.
Gap-Analyse
Auf dem Weg zur Zertifizierung identifizierten die Spezialisten bei Method Park zunächst mithilfe einer Gap-Analyse die notwendigen Verbesserungen oder Ergänzungen der vorhandenen Prozesse. Diese Analyse bestand aus zwei Schritten:
- Durchführung eines internen Audits und
- Mapping der Anforderungen der Norm auf die vorliegenden Prozessteile des Standard-Engineering-Prozesses innerhalb von Stages.
Das interne Audit hatte vorrangig den Zweck
- schwerwiegende Nicht-Erfüllungen der Norm aufzudecken,
- Abweichungen zu entdecken, um Lösungen erarbeiten zu können,
- Empfehlungen zu erteilen im Hinblick auf die Behebung der aufgedeckten Abweichungen sowie
- eine Vorgehensweise und Schwerpunkte für das Zertifizierungsprojekt zu definieren.
Prozessmanagement-Tools wie Stages ermöglichen ein Mapping zwischen einem hinterlegten Prozessmodell und einem tatsächlich umgesetzten Prozess. Dadurch wird sehr schnell deutlich, in welchen Teilen der Prozess zu verbessern ist beziehungsweise inwieweit er die vorliegende Norm erfüllt. Dieses Mapping sollte in Kombination mit den Ergebnissen der Gap-Analyse als Leitfaden dienen und zeigen, an welchen Stellen des Prozesses gearbeitet werden musste.
- Fit für ISO 13485
- Strukturierte Arbeitsweise
- Lessons learned

