Ionentherapie
Mit PXI gegen Krebs
Nachdem das Großforschungsprojekt LHC am CERN wohl doch keine schwarzen Löcher produziert und das Higgs-Boson entdeckt zu sein scheint, wird deutlich, dass sich das gewonnene Know-how auch in modernen Behandlungsmethoden für hartnäckige Tumore nutzen lässt.
Bis zu 1400 Patienten pro Jahr sollen im Vollbetrieb im »Med-Austron«, einem Zentrum für Ionentherapie in Wiener Neustadt, behandelt werden können, nachdem es voraussichtlich 2015 den Patientenbetrieb aufnehmen wird. Dass sich »ein Stück LHC im MedAustron« befindet, verkündete Ende 2012 der damals für das System-Engineering Verantwortliche bei CERN. Von den Erfahrungen bei Bau und Betrieb des »Large Hadron Collider« profitieren Forschungsprojekte auf der ganzen Welt.
Die Besonderheit bei MedAustron ist, dass dort sowohl Ionen- als auch Protonentherapie angeboten werden soll, was durchaus ungewöhnlich ist, da die Beschleunigung eines Kohlenstoffions deutlich andere Energien benötigt, als jene eines Protons. Grundsätzlich suchen beide Methoden jedoch denselben Effekt: die Zerstörung des Tumorgewebes möglichst ohne Beeinträchtigung der umliegenden gesunden Bereiche.
Die Protonentherapie ermöglicht durch ihre Zielgenauigkeit die Behandlung von Tumoren auch in sensiblen Körperregionen. Der Beschleuniger liefert Protonen mit bis zu 60% der Lichtgeschwindigkeit als gebündelten Strahl, der präzise auf den vorher berechneten Ort im Tumorgewebe gelenkt werden kann. Beim Eindringen in den menschlichen Körper wird der Strahl so gebremst, dass die Protonen den größten Teil ihrer Energie direkt im Tumorherd abgeben. Die ionisierende Wirkung der Protonen schädigt dann die Tumorzellen, insbesondere deren DNS.
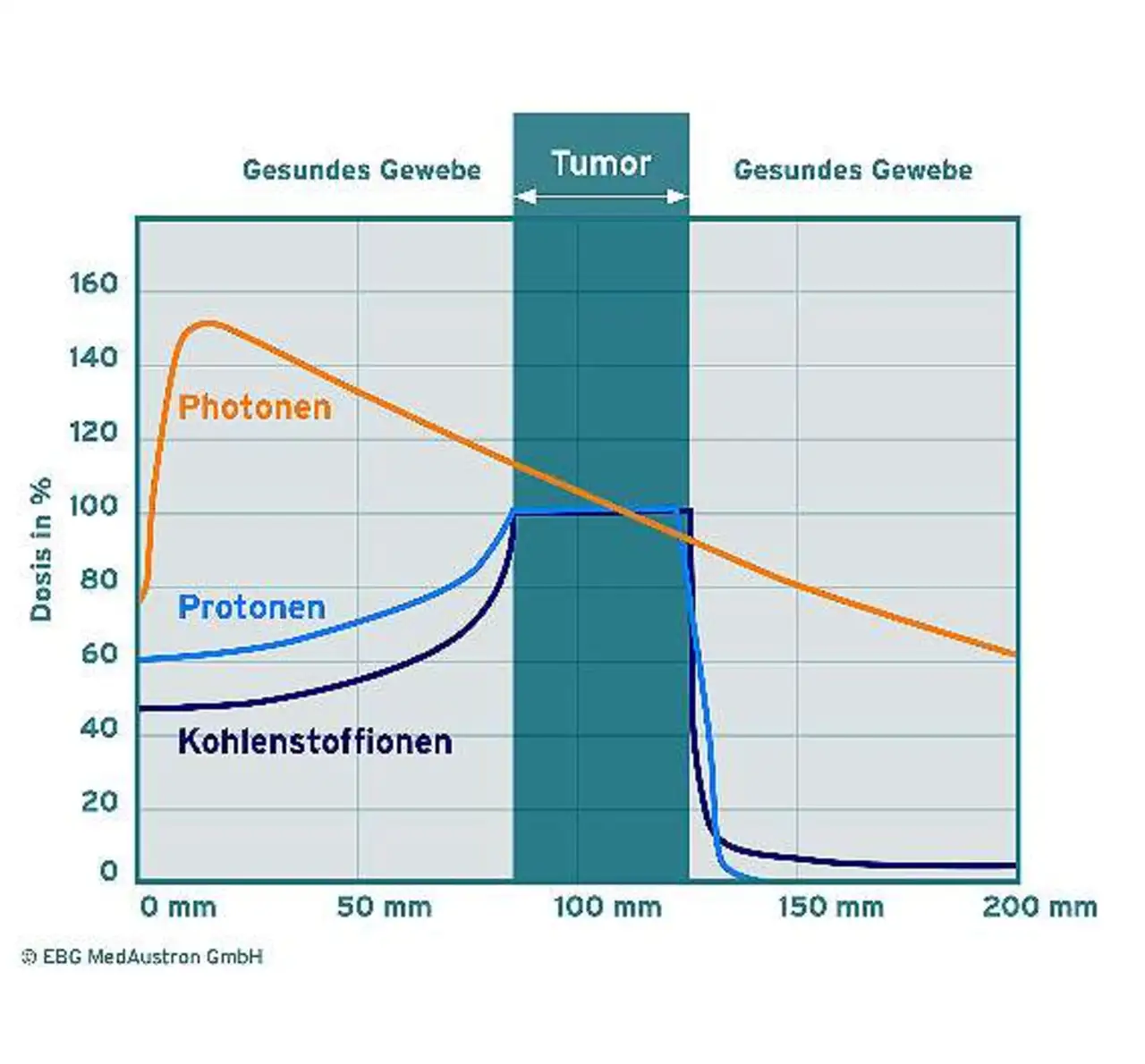
Durch die dreidimensional präzise Protonendeposition ist die dadurch erreichbare Strahlendosis im Ziel höher als beim Einsatz der konventionellen Röntgenstrahlung und der mittels Linearbeschleuniger erzeugten Photonen (Bild 1).
Im Vergleich mit anderen Bestrahlungsformen sinkt bei der Protonentherapie deshalb auch das Risiko von Nebenwirkungen. Umgebendes, gesundes Gewebe wird weitgehend geschont.
Wenn die schwereren Kohlenstoffionen zum Einsatz kommen sollen, wird die präzise Steuerung noch wichtiger. Ionisierte Kohlenstoffatome eignen sich besonders zur Behandlung tief liegender Tumore, denn sie liefern am Ziel eine besonders hohe Dosis mit sehr geringen Streuverlusten im umliegenden Gewebe. Hinzu kommen eine gegenüber Protonen höhere biologische Wirksamkeit auf Tumoren und ein besonderer Nebeneffekt: Der Kohlenstoffstrahl erlaubt eine genaue Strahllokalisierung durch entstehende Kohlenstoffisotope, deren Emissionen in einer Positronen-Emissions-Tomografie (PET) als Sicherheitskontrolle und Nachweismonitor dienen. Auf ihrem Weg durch das Gewebe werden einige Kohlenstoffionen in leichtere Kohlenstoffisotope umgewandelt, die Positronen emittieren. Treffen diese Positronen auf Elektronen, emittieren sie zwei charakteristische Photonen unter einem Winkel von 180°. Auf ihrem Weg in den Körper sorgen einige Teilchen in einem gasdurchflossenen Detektor für eine statistische Ionisation auf einem Metallgitter. Aus den Sensordaten des Detektors lässt sich der Winkel des Strahls und somit dessen Position im Gewebe errechnen und mit den im Therapieplan festgelegten Sollwerten vergleichen und die Ablenkung gegebenenfalls korrigieren.
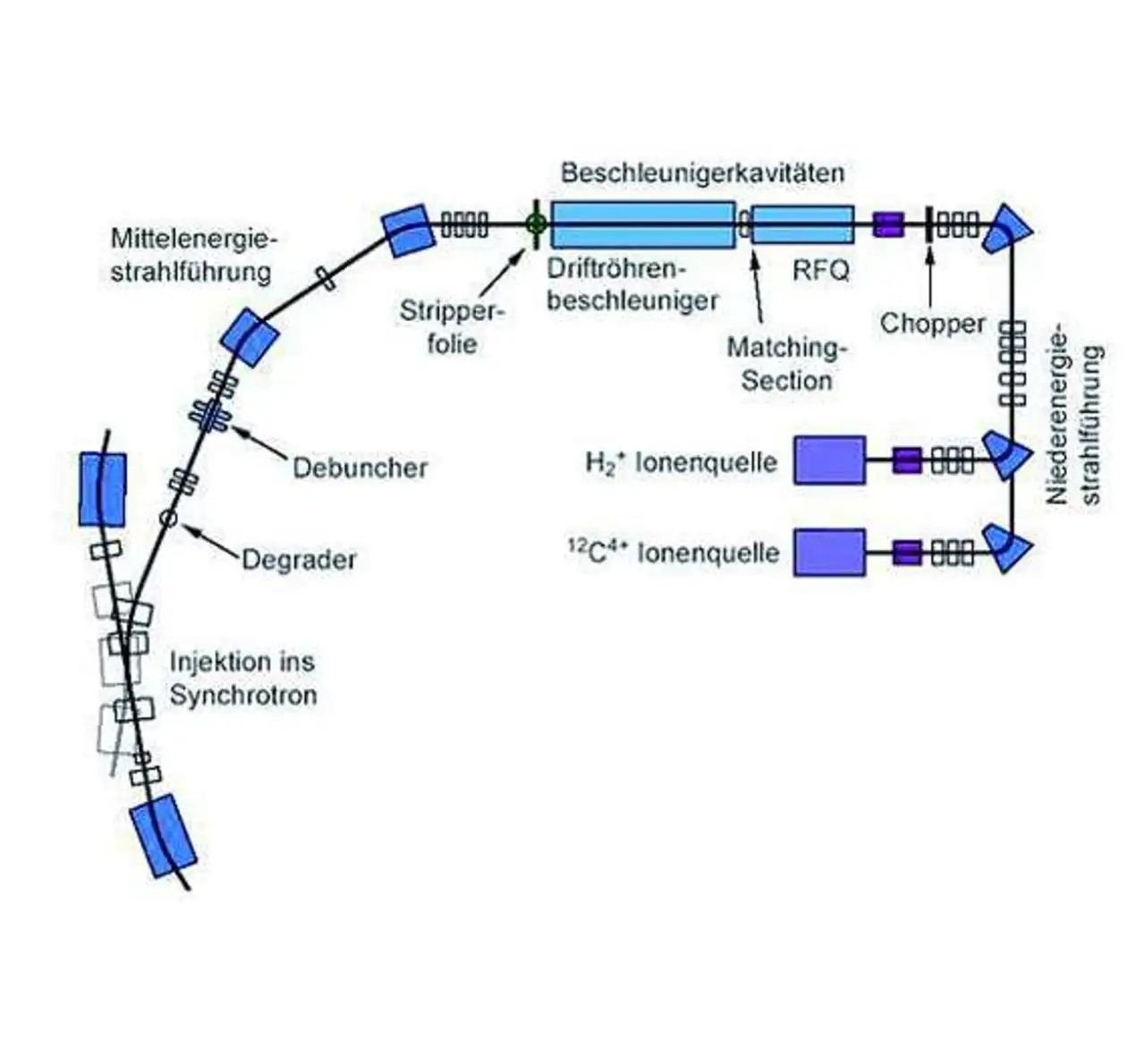
Bei beiden Verfahren wird in der Therapievorbereitung der Tumor möglichst genau vermessen und in Schichten gleicher Dicke aufgeteilt. Diese Schichten werden dann von einem Ionenstrahl mit genau definierter Energie Punkt für Punkt abgetastet, sodass jeder Punkt eine vorherberechnete Strahlendosis erhält, die das Tumorgewebe zerstört. In Wiener Neustadt werden nun – zurzeit im Testbetrieb – beide Methoden eingesetzt. Dazu ist komplexe Technik notwendig. Der gesamte Teilchenbeschleuniger bei MedAustron besteht aus über 1000 Komponenten, die von über 230 Herstellern aus 22 verschiedenen Ländern bezogen werden.
Drei Ionenquellen erzeugen die für die Bestrahlung notwendigen Teilchen, also Protonen oder Kohlenstoffionen (Bild 2). Der sogenannte »Linac-Bunker« (Linear Accelerator, also Linearbeschleuniger) beschleunigt diese geladenen Teilchen auf gerader Strecke durch elektrische Wechselfelder auf 36 000 km/s (circa 12% der Lichtgeschwindigkeit), woraufhin sie ins Synchrotron eintreten. Dieser Kreisbeschleuniger mit einem Umfang von 80 m bringt sie dann auf ihre Endgeschwindigkeit, etwa 200 000 km/s (rund zwei Drittel der Lichtgeschwindigkeit). Das Synchrotron wurde auf Basis des im Hadronentherapiezentrum CNAO in Pavia nahe Mailand erprobten Designs in enger Kooperation mit dem CERN entwickelt.
Der Patient am Beschleuniger
Im Anschluss wird der Ionenstrahl in die Bestrahlungsräume geleitet. MedAustron verfügt über vier Bestrahlungsräume, wovon drei der Patientenbehandlung und einer der nichtklinischen Forschung dienen. So gibt es einen medizinischen Bestrahlungsraum mit horizontalem Fixstrahl, einen mit horizontalem und vertikalem Fixstrahl sowie einen mit einem Drehgestell (Gantry), das die Bestrahlung von Patienten aus beliebigen Winkeln mit einer Strahlgenauigkeit von 0,3 mm ermöglicht. Das Drehgestell hat ein Gesamtgewicht von 220 Tonnen und einen Drehdurchmesser von 7,5 m. Der Raum zur nichtklinischen Forschung soll besonders den Bereichen Strahlenbiologie, medizinische Strahlenphysik sowie Experimentalphysik dienen.
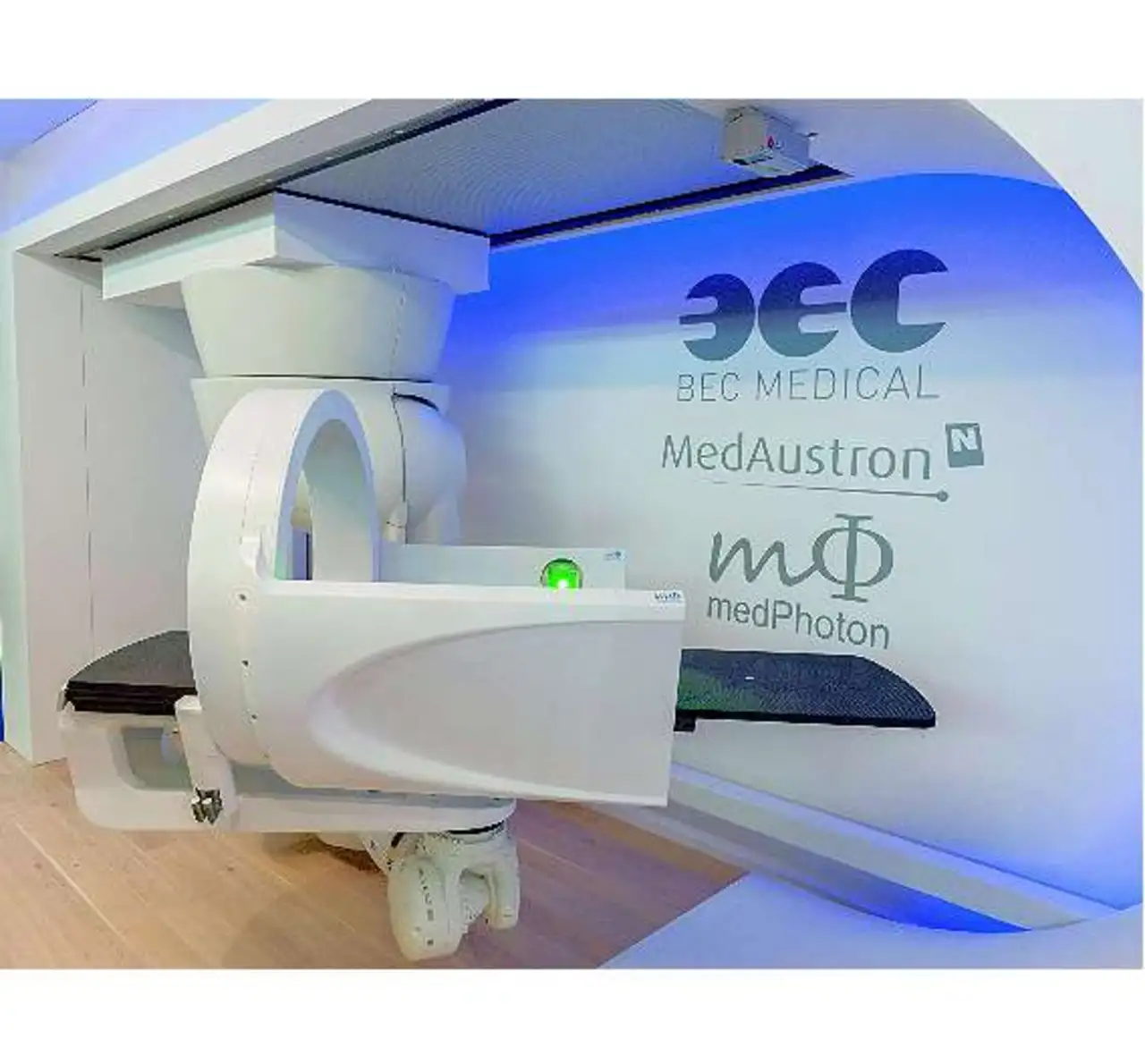
Ein wesentlicher Faktor bei der Behandlung ist die exakte Positionierung der Patienten. MedAustron verfügt über ein spezielles Positionierungssystem: ein deckenmontiertes robotisches System (Bild 3), bei dem speziell für den medizinischen Einsatz adaptierte Industrieroboter zur Anwendung kommen und das in Zusammenarbeit mit Buck Engineering entwickelt wurde. Es ermöglicht, die Patienten mit einer Genauigkeit eines halben Millimeters zum Therapiestrahl auszurichten, die exakte Positionierung während der gesamten Behandlung sicherzustellen und so die präzise Bestrahlung des Tumors durchzuführen.
Das sogenannte »Ring Imaging System« (RIS) verifiziert die korrekte Position des Patienten per CBCT (Cone Beam Computer Tomography). Es besteht aus einer Röntgenröhre und einem Detektor, die dank ihrer Kompaktbauweise direkt am Patiententisch montiert sind. Die zentrale Steuerungs- und Administrationssoftware der Patientenbehandlung wird von medPhoton am radART-Institut der Medizinischen Privatuniversität Paracelsus entwickelt. Dabei wird nicht nur den besonderen medizinischen Anforderungen der Ionentherapie Rechnung getragen, sondern auch die Gesamtsteuerung der Bestrahlungsräume sowie die Überwachung der Patientensicherheit übernommen.
Bei der Strahlsteuerung kommen PXI-Systeme von National Instruments zum Einsatz. Neben der Strahldiagnostik ist besonders die Steuerung der 352 Magnete von Bedeutung, außerdem müssen insgesamt 283 Leistungswandler mit zusammen 12 MW unbedingt synchron laufen. Für diese Power-Converter wurde eine Echtzeitsteuerung benötigt, für die PXI aufgrund der begrenzten Bandbreiten nicht tauglich war. Stattdessen fand PXI-Express Verwendung. Alle Leistungswandler werden von acht PXI-Express-Systemen mikrosekundengenau mit 48 »FlexRIO«-Modulen über Glas-faserleitungen gesteuert.