ISSCC 2013
Die Medizinelektronik der Zukunft
In kaum einem anderen Bereich spürt der Mensch den Nutzen von Mikroelektronik derartig wie in der Medizin, wo sie bei Diagnose und Behandlung neue Wege eröffnet. Auf der ISSCC wurden neuartige Ansätze etwa für die Abschwächung epileptischer Anfälle, Iontophorese und Elektromyogramme vorgestellt.
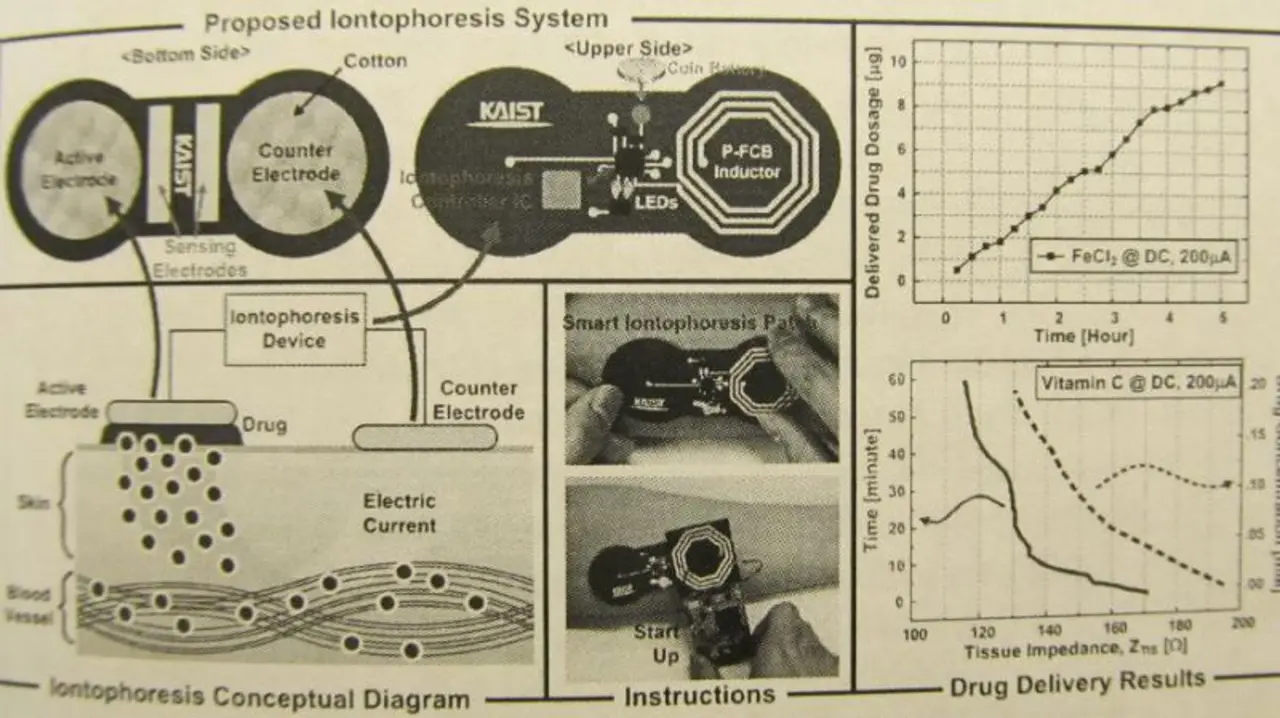
In einem Vortrag des KAIST (früher Korea Advanced Institute of Science and Technology), einer südkoreanischen Universität mit dem Hauptsitz in Daejeon, ging es um Iontophorese, ein medizinisches Verfahren zur Resorption von Arzneistoffen durch die Haut unter Anwendung eines schwachen elektrischen Gleichstromes.
Die Dosierung des Arzneistoffes geschieht dabei durch die Anpsssung der Stromstärke und der Zeitdauer, für die der Strom fliesst. Genutzt wird dieses Verfahren heute u.a. für die Schmerztherapie, Ödem- und Rheumabehandlung, bei der der Arzneistoff in ein Gelenk eindringen soll, und sogar für nicht-medizinische Zwecke wie die Einbringung von Vitamin C aus kosmetischen Gründen. Das Medikament wird auf feuchtes Zellstoffpapier unter eine Elektrode gebracht. Elektrisch positiv geladene Arzneistoffe (Kationen) werden unter die positive Elektrode platziert, negativ geladene Arzneistoffe (Anionen) unter die negative Elektrode.
Traditionell nutzen derartige Systeme lediglich eine DC-Batterie ohne Controller. Das Problem dabei sind wechselnde Last-Impedanzen und Spannungsabfälle, was zu fehlerhaften Wirkstoffabgaben führt. Desweiteren ist es mit diesen Systemen nicht möglich, die Menge des abgegeben Wirkstoffes und den Hautzustand des Patienten in Echtzeit zu erfassen, was für eine exakte Abgabe notwendig wäre.
Die koreanischen Forscher haben nunmehr ein Controller-IC entwickelt, das in Echtzeit den Hautzustand sowie die abgegebene Wirkstoffmenge misst. Es enthält einen Temperatursensor und einen dualen Impedanz-Sensor, um die Hauttemperatur und die Übergangsimpedanzen Elektrode/Zellstoffpapier sowie Zellstoffpapier/Haut zu messen. Desweiteren gibt es eine programmierbare Stromquelle mit 32 Stufen. Das Wirkstoffabgabesystem liefert mit 87 mA x min eine höhere Dosierung als die von heute kommerziell verfügbaren Geräten (80 mA x min).
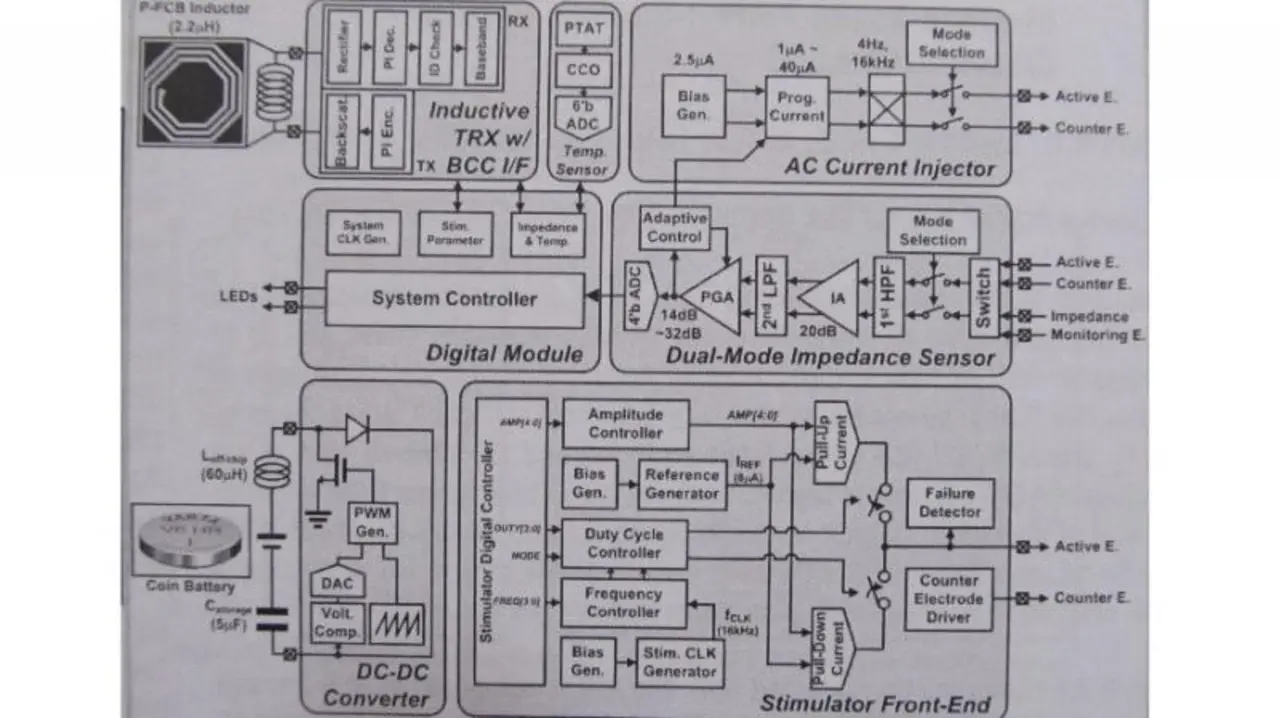
Bild 1 zeigt das System, das über eine externe Basisstation gestartet und programmiert wird. Hauttemperatur und Impedanzen werden minütlich gemessen und im 4 KB großen SRAM gespeichert oder mittels der Kommunikationsschnittstelle an die Basisstation übertragen. Wenn ein Fehler z.B. durch einen schlechten Kontakt auftritt oder die Wirkstoffabgabe beendet ist, geht eine LED an. Die Wirkstoffabgabe über die Zeit kann aus den SRAM ausgelesen werden.
Bild 2 zeigt das Blockdiagramm des Controller-ICs. Ein DC/DC-Wandler generiert aus der 1,2-V-Knopfbatterie eine Spannung von 3,3 V, über das Front-End wird die Wirkstoffabgabe programmiert, desweiteren finden sich die Sensoren, ein induktiver Transceiver und ein System-Controller mit Taktgenerator.
Der maximale Strom beträgt bei 5 KΩ Ausgangslast 512 µA, was bei Abgabe von z.B. 8,5 µg FeCl2 in der Schmerztherapie in 170 Minuten ermöglicht. Der Chip wird in einem 0,11-µm-CMOS-Prozess gefertigt und ist 5,5 mm2 groß. Die maximale Leistungsaufnahme bei einem Strom von 512 µA beträgt 2,2 mW, die beiden Impedanzsensoren nehmen nur 70 µW auf. Mit einer Knopfbatterie, die eine Kapazität von 6,2 mAh bei 1,2 V aufweist, kann somit eine Betriebszeit von mehr als 2,8 h erreicht werden.
Epileptische Anfälle proaktiv unterdrücken
Um die Auswirkungen eines epileptischen Anfalls zumindest abzumildern, wurden schon in der Vergangenheit SoCs entwickelt, die den bevorstehenden Ausbruch an Hand von Hirnstromaktivitäten erkennen können, bevor die klinischen Symptome auftreten. Durch Neurostimulation Bei der Neurostimulation – hier hemmen die Stromimpulse eines Neurostimulators die Erregungsweiterleitung überaktiver Nerven – können die Auswirkungen gemildert werden.
Heutige Systeme leiden jedoch an langen Latenzzeiten, geringer Erkennungsrate und einer vergleichsweise hohen Fehlerkennungsrate. Forscher des Masdar Insitute of Science and Technology aus Abu Dhabi ist es jetzt gelungen, ein SoC mit geringer Latenzzeit (<2 s), hoher Erkennungsrate (< 95 %) und weniger als 1 % Fehlalarmen zu entwickeln.
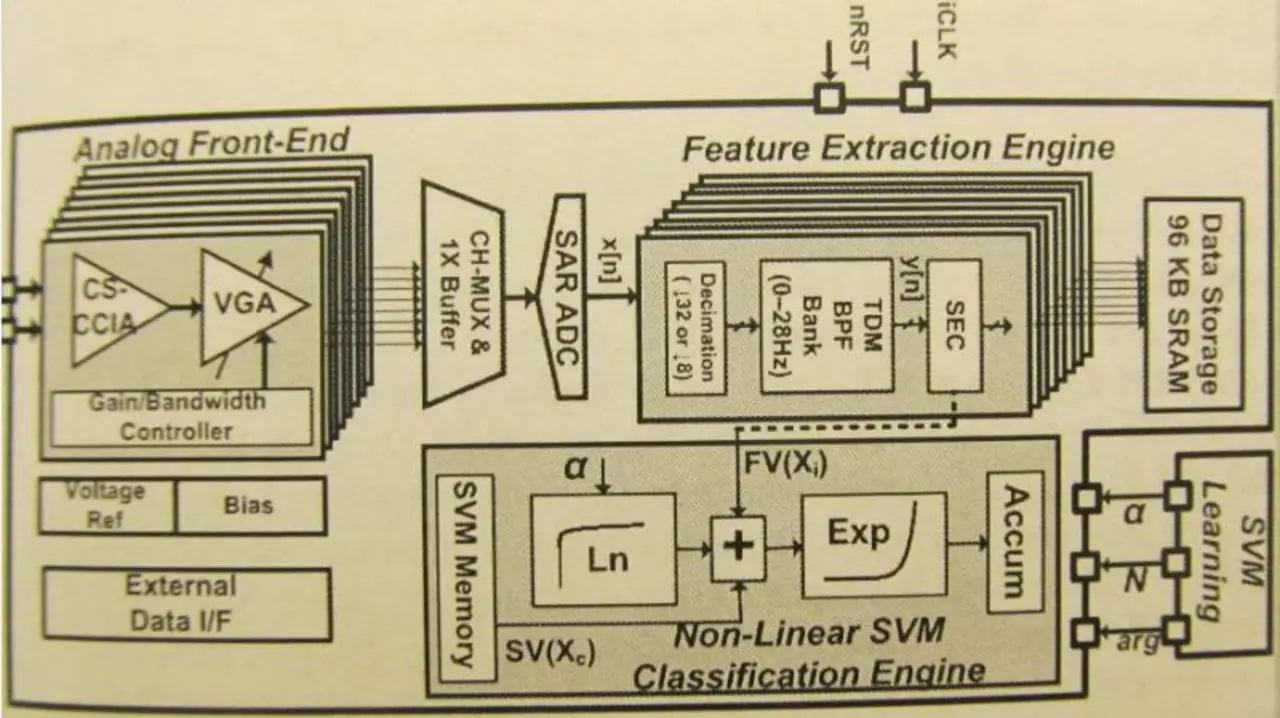
Das Bild zeigt den Aufbau des SoCs, das in einem 0,18-µm-CMOS-Prozess gefertigt inklusive 96 KB SRAM rund 25 mm2 Silizum in Anspruch nimmt. Neben dem achtkanaligen analogen Frontend erkennt man die sogenannte Feature-Extraction-Engine, welche eine nichtlineare Support-Vector-Maschine (SVM) implementiert. Ein Test mit einer Datenbank am MIT-Kinderkrankenhaus in Boston, die 996 Stunden EEG-Aufzeichnungen mit 196 Anfällen und 23 unterschiedlichen Epilepsie-Patienten enthält, ergab eine Erkennungsrate von 95,1 %, 0,94 % Fehlalarme und Latenzzeiten von weniger als 2 s.
Oberflächen-EMG-Messfeld
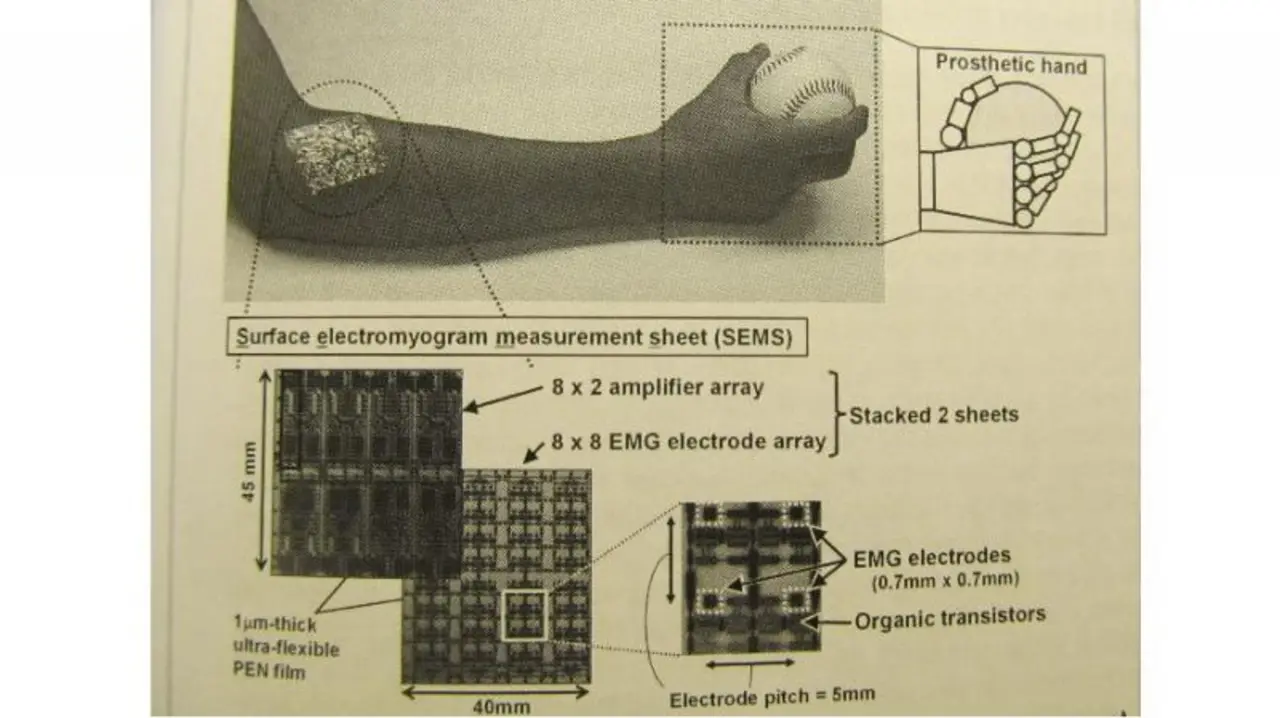
Last but not least stellten Forscher der Universität Tokio ein sogenanntes Oberflächen-EMG-Messfeld (SEMS) vor. Die Elektromyografie (EMG) ist eine elektrophysiologische Methode in der neurologischen Diagnostik, bei der die elektrische Muskelaktivität gemessen wird. Durch Messungen der Potentialänderungen auf der Haut mit Oberflächenelektroden kann der menschliche Wille, Hände oder Beine zu bewegen, festgestellt werden und entsprechende Prothesen angesteuert werden. In diesem Fall geht es um eine Handprothese.
Bei der Durchführung eines EMGs wird die elektrische Aktivität im ruhenden Muskel (Spontan-Aktivität) und bei unterschiedlich stark willkürlich kontrahiertem Muskel (Muskel-Aktionspotentiale) gemessen. Die Potentialquelle des EMG ist das Membranpotential der Muskelzelle, innen -70 mV gegenüber außen. Bei Erregung einer Muskelzelle, etwa über die motorische Endplatte, öffnen sich Ionenkanäle und führen zu einer kurzzeitigen (ca. 1 ms) und lokalen Umkehr des Membranpotentials. Diese Potentialänderung ist messbar. Welche Potentialdifferenz der Eingangsverstärker des Elektromyographen dabei erfasst, ist von sehr vielen physikalischen und physiologischen und letztlich auch pathologischen Faktoren abhängig: von der Entfernung der Elektrode von der Signalquelle (Abschwächung mit der dritten Potenz der Entfernung), von der Anzahl und Art der gleichzeitig aktiven Muskelfasern, von der räumlichen Anordnung von leitenden und isolierenden Gewebekomponenten und vielen anderen Faktoren mehr. Es resultiert ein sehr komplexes, elektrisches Feld. Das Messergebnis wird sowohl von kapazitiven als auch ohmschen Widerständen bestimmt. Im Resultat wird in einer typischen medizinisch neurologischen Messanordnung für ein EMG ein Signal gemessen, das Potentiale im Bereich von 50 μV bis zu einigen mV erfasst. Die Entladungen einzelner motorischer Einheiten stellen sich dann als Potentialschwankungen von etwa 10 ms Dauer dar und enthalten Frequenzkomponenten bis einige kHz.
Die Problematik herkömmlicher Systeme besteht darin, dass die Messung über einen längeren Zeitpunkt dank starrer Elektroden sehr störend für den Patienten ist und die Signalintegrität mit der Anzahl der Messpunkte abnimmt, da damit die Anzahl der Kabel zwischen Elektroden und analogem Frontend zunimmt.
Die japanischen Forscher haben nun ein 8x8-Elektroden-Array und ein 8x2-Verstärker-Array, die mittels organischen Transistoren (2 V) aufgebaut wurden, zusammen auf einen 1 µm dicken flexiblen Film aufgebracht, der an entsprechenden Stellen des Arms aufgebracht wird (Bild).
Der Abstand der Elektroden beträgt 0,7 mm, die Fläche des Arrays 3,5 mm2. Um die Signalintegrität zu verbessern, schließen sich Verstärker an, wobei auf Grund des hohen Flächenbedarfs sich 4 Elektroden einen Verstärker teilen. Beide Arrays werden dann übereinandergestapelt, um den Flächenbedarf zu reduzieren.