Datenverwaltung
Bioinformatik hilft heilen
Die computergestützte Modellierung von Krankheitsprozessen ist ein wertvolles Mittel für die Auswertung umfangreicher Patientendaten. Die komplexen biologischen und klinischen Zusammenhänge, die in diesen Daten enthalten sind, erfordern hochentwickelte statistische, algo-rithmische und numerische Verfahren. Die Integration mehrerer Modelle für unterschiedliche Aspekte einer Krankheit verspricht Fortschritte für Diagnose, Prognose und Therapie.
Die Erhebung und Speicherung einer Fülle von molekularbiologischen und medizinischen Daten ist einfacher und billiger denn je. Die große Schwierigkeit besteht darin, dies in sinnvoller Weise zu tun und aus den Daten Nutzen zu ziehen. An dieser Stelle können komplexe Computermodelle entscheidende Unterstützung bieten.
Der technische Fortschritt und die Entwicklung neuer experimenteller Verfahren haben der Medizin vielversprechende Forschungsrichtungen eröffnet. So kann man von einem Patienten einen aussagekräftigen »molekularen Fingerabdruck« nehmen, der unter anderem Informationen über seinen Genotyp, den Aktivitätszustand seiner Gene sowie Stoffwechselprodukte enthält.
Eine Sammlung derartiger Daten birgt die Möglichkeit, einen Biomarker für eine spezielle Krankheit zu identifizieren, also einen Indikator für ein erhöhtes Erkrankungsrisiko oder einen bereits erfolgten Ausbruch. Indem Forscher die Aktivität der Gene innerhalb einer Zelle manipulieren, gewinnen sie Einblick in die intrazellulären Prozesse in gesundem und krankem Gewebe. Sollte es gelingen, daraus das Netzwerk der beteiligten chemischen Reaktionen zu rekonstruieren, so kann auf Basis detaillierter quantitativer Modelle eine Prognose und Therapieempfehlung gegeben werden.

Zudem ist es bei den heutigen Rechen- und Speicherkapazitäten kein Problem mehr, zu einer bestimmten Krankheit eine Datenbank zu erstellen, welche die Vorgeschichte vieler Patienten sowie Laborbefunde, Klinikaufzeichnungen und relevante Gewebeproben zusammenführt (Bild 1).
Gelingt es, diese riesigen Datenmengen zu bewältigen und sinnvoll auszuwerten, so können wir auf Entscheidungshilfen und Therapien hoffen, die sich nicht auf den Durchschnittspatienten, sondern auf die konkrete Einzelperson beziehen. So kann der Arzt neben der Vorgeschichte und den klassischen klinischen Befunden auch die Messwerte für die Biomarker in seine Therapieentscheidung einbeziehen. Die Aussichten sind vielversprechend, doch gegenwärtig hat die Forschung noch viele Hindernisse zu überwinden.
Wir brauchen dringend mehr systematisch erhobene krankheitsspezifische Daten, vor allem Längsschnittstudien, die das Schicksal eines einzelnen Patienten über einen längeren Zeitraum erfassen. Bei s
Rechtliche und ethische Hürden kommen hinzu. Patienten müssen darauf vertrauen können, dass ihre Daten nicht missbraucht werden; Kliniken sehen nur allzu häufig keinen Anlass, die Daten, die sie als ihr Eigentum ansehen, zu Forschungszwecken herauszugeben. Hier gilt es, Strukturen zu entwickeln, die es den Datensammlern schmackhaft machen, ihre Daten zur Verfügung zu stellen.
Im Fall der Grippe ist eine solche Hürde in den letzten Jahren überwunden worden. Hat man aus den Daten interessante Muster extrahiert, so braucht es verlässliche, genaue und vertrauenswürdige statistische Verfahren, um diese richtig zu bewerten. Nur allzu leicht kommt man von einer kleinen Stichprobe aus komplexen Daten zu falsch-positiven Befunden. Ebenso wichtig ist es, die Ergebnisse einer Simulationsrechnung in einer Form bildlich zu präsentieren, die Wissenschaftlern und den behandelnden Medizinern unmittelbar einleuchten, besonders wenn es um sehr komplexe biologische Systeme geht.
Impfstoffdesign am Computer
Ein besonderes Anliegen der Forschung ist die numerische Modellierung von Infektionskrankheiten (Bild 2). Da sehr viele Menschen weltweit unter Aids, Tuberkulose, Hepatitis C, Grippe oder Malaria leiden, können erfolgreiche Modelle hier große Wirkungen erzielen. Sie müssen jedoch regelmäßig nachgebessert werden, um mit der raschen Evolution der Erreger Schritt zu halten.
Für die Wechselwirkung zwischen Krankheitserreger und Wirt lässt sich auf der Grundlage von molekularen Interaktionsnetzen ein dynamisches Modell erarbeiten. Gelänge es, damit quantitativ zu beschreiben, wie Erreger sich innerhalb einer Zelle vermehren oder innerhalb des Körpergewebes ausbreiten, wäre dies ein bedeutender Fortschritt.
Computermodelle können das Design neuer Impfstoffe entscheidend unterstützen, zum Beispiel bei Impfstoffkombinationen aus einem Antigen und einem Adjuvans, das die Immunreaktion verstärkt. Durch Datenanalyse lassen sich zudem Biomarker ausfindig machen, die frühzeitig anzeigen, ob ein neuer Impfstoff wirksam ist oder nicht, und damit langwierige und teure klinische Studien einsparen. Auch können Computermodelle jene Mutationen erfassen, durch die Bakterien und Viren einer Immunreaktion entgehen.
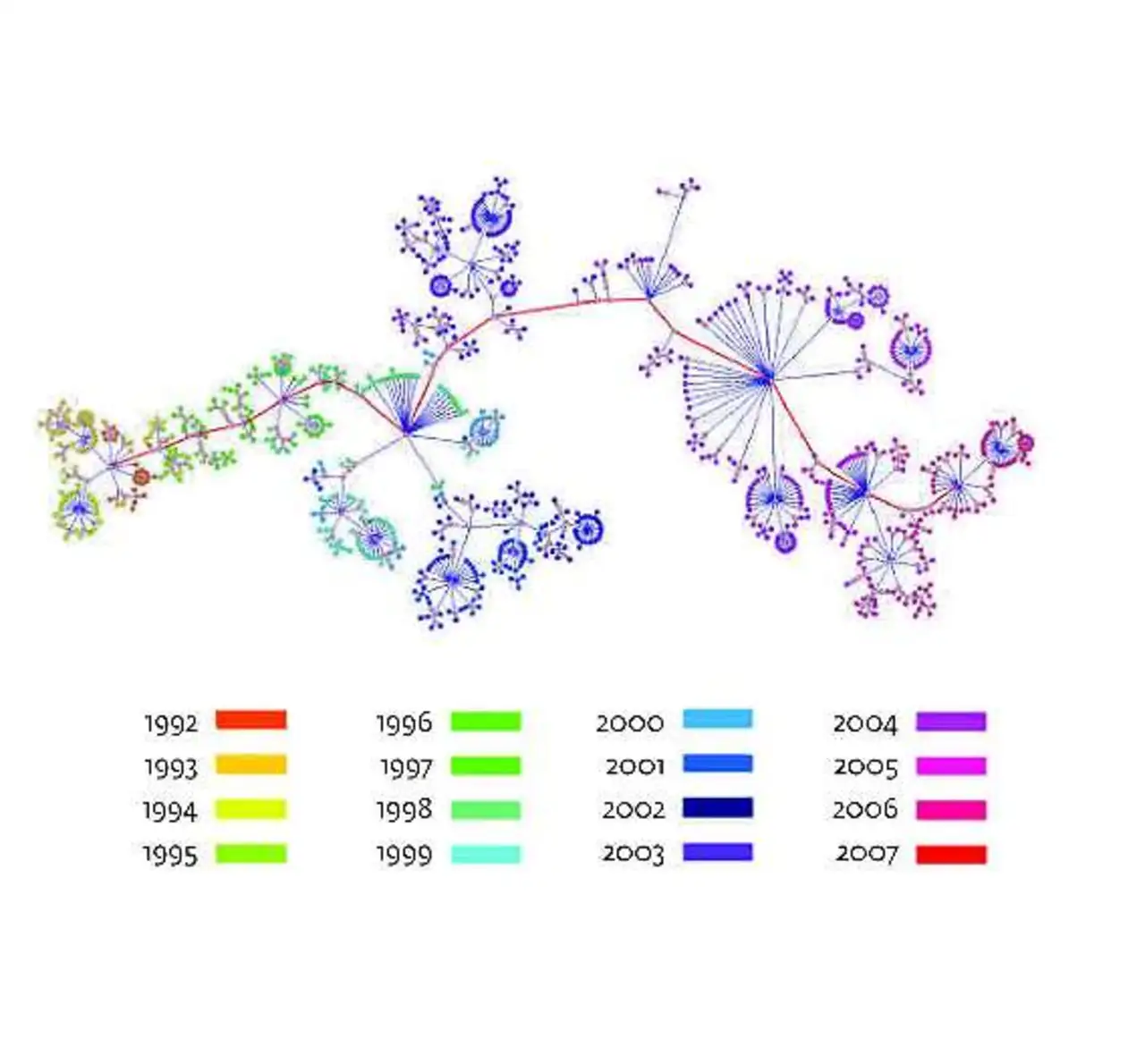
So lässt sich der Prozess der jüngsten evolutionären Veränderung des Keims analysieren (Bild 3). Dieses Wissen wird bereits dazu genutzt, für die Produktion des Impfstoffs für die saisonale Grippe geeignete Virenstämme auszuwählen. Auch im individuellen Krankheitsverlauf mutieren die Erreger und entwickeln dadurch Resistenzen gegen die verabreichten Medikamente.
Ein statistisches Modell kann diesen Prozess vorwegnehmen und so Prognosen zum Erfolg verschiedener Behandlungspläne abgeben (siehe Kasten »Bioinformatik und HIV«). Weiterentwickelte Formen dieser Softwarewerkzeuge werden auch die genetische Ausstattung des Patienten sowie die bisherige Behandlung in die Empfehlung einbeziehen.
Indem ein Modell über die Biologie hinaus Daten zur Demographie und zum Sozialverhalten des Menschen einbezieht, kann es schließlich epidemiologische Voraussagen über das Ansteckungsrisiko und über die Ausbreitung einer Krankheit auf lokaler und globaler Ebene treffen. Die meisten gegenwärtigen Modelle erfassen nur einen sehr begrenzten Ausschnitt des Krankheitsgeschehens.
Realitätsnähere und nützlichere Softwarewerkzeuge entstehen erst durch Integration dieser Ansätze zu umfassenderen, dynamischen Modellen. Dies wird zweifellos eine Herausforderung, nicht zuletzt, weil sich das Geschehen über viele zeitliche Größenordnungen erstreckt: von den Mikrosekunden für eine einzelne chemische Reaktion bis hin zu den Tagen oder sogar Jahren für den Verlauf einer Krankheit und der Genesung.
Viele der hier angesprochenen Projekte stecken noch in einem frühen Stadium; aber in den nächsten fünf Jahren ist mit beträchtlichen Fortschritten zu rechnen. Die rechnerische Modellierung von Krankheiten wird dem Patienten vielfältigen Nutzen bringen: verbesserte Diagnosen und Prognosen, neue Behandlungsmethoden - und eine deutliche Minderung des Risikos durch unzweckmäßige oder gar schädliche Behandlung.
Über den Autor:
Prof. Dr., PH. D., Thomas Lengauer ist Direktor des Max-Planck-Instituts für Informatik.
| Bioinformatik und HIV |
|---|
| Am Max-Planck-Institut für Informatik wurden bioinformatische Modelle der HIV-Infektion entwickelt, die bereits die Therapie von Aidspatienten unterstützen. Sie wurden zusammen mit Virologen und Ärzten in ganz Deutschland mit statistischen Lerntechniken abgeleitet und basieren auf klinischen Daten eines Zeitraums von zwei Dekaden (www.geno2pheno.org). Sie helfen besonders in den letzten Stadien der Infektion (Lengauer, T. & Sing, T. nat. Rev. Microbiol. 4, 790-797 2006). |