Normen und Zertifizierungen
Geregelte Software
Software-Entwicklungsunternehmen, die sich in der Medizintechnik bewegen, sind häufig von der Vielfalt an regulativen Anforderungen überwältigt. Tatsächlich ist es bereits eine Herausforderung, überhaupt den Überblick zu bekommen. Ein Entwicklungs-Framework soll helfen, diese zu meistern.
Um ein medizinisches Gerät zu vermarkten, müssen bei der Herstellung verschiedene regulatorische Anforderungen erfüllt werden. Da heute die Software eine zunehmend wichtige Rolle spielt, müssen die Hersteller dafür sorgen, dass diese in verschiedener Hinsicht sicher ist. Dies geschieht durch die Definition und Implementierung effektiver Software-Entwicklungsprozesse. Diese Prozesse basieren auf anerkannten Prinzipen für Entwicklung von sicherheitskritischen Systemen. Eine Grundvoraussetzung für das Design der medizinischen Gerätesoftware ist, dass es die mit der Herstellung verbundenen regulatorischen Anforderungen erfüllt. Um Entwickler bei der Erfüllung dieser Normen zu unterstützen, wurde der Framework »MDevSPICE« kreiert. In diesem Rahmenwerk wurden sowohl internationale Standards und Guidance-Dokumente für die Software-Entwicklung für medizinische Geräte als auch »best practices« des Software-Engineerings vereint.
Regulatorische Mechanismen
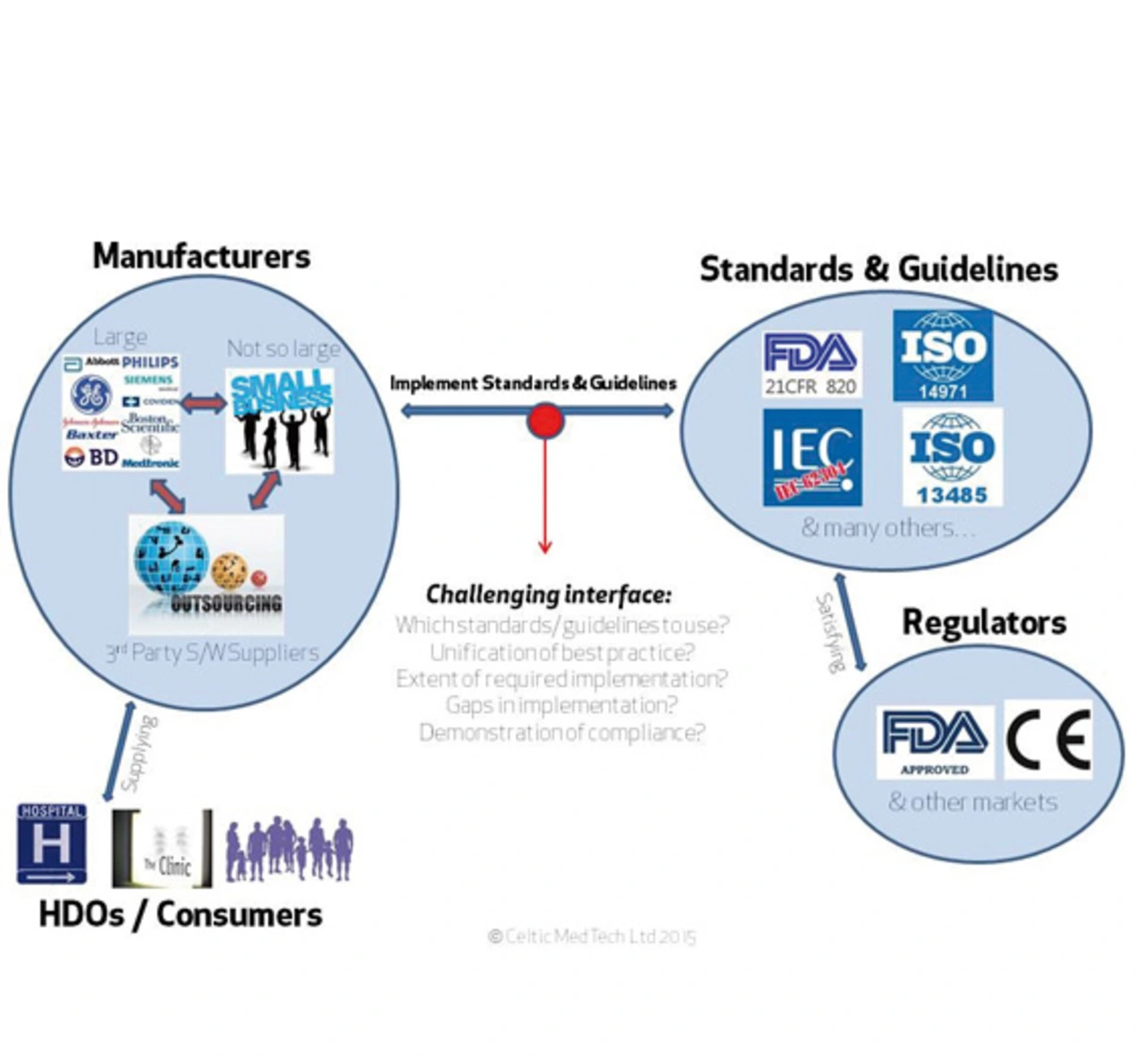
Um ein Medizinprodukt in einer bestimmten Region vertreiben zu können, müssen die regulatorischen Anforderungen dieser Region erfüllt sein. Bild 1 beschreibt die Regulierungslandschaft von Medizinprodukten, indem sie die Verbindung zwischen Herstellern von Medizingeräten, ihren Kunden und Aufsichtsbehörden darstellt. Zwei der weltweit größten globalen Gremien zur Ausgabe und Verwaltung der medizinischen Produkt-Verordnungen gehören zu den zentralen Regierungsfunktionen der USA und der EU (»Regulators« in Bild 1). Beispiel USA: Hier gibt der FDA (Food and Drug Administration) die relevanten Vorschriften durch eine Reihe von offiziellen Kanälen, einschließlich des CFR (Code of Federal Regulation) Titel 21, Kapitel I, Unterkapitel H, Teil 820 heraus. In der EU ist die entsprechende Regelung in der allgemeinen Richtlinie über Medizinprodukte (MDD) 93/42/EWG, Richtlinie für aktive implantierbare medizinische Geräte (AIMDD) 90/385/EWG und Richtlinie für In-vitro-Diagnostika (IVD) 98/79/EG umrissen. Diese drei Richtlinien wurden um die Änderungsrichtlinie 2007/47/EG ergänzt und von der Europäischen Kommission herausgegeben. Somit sind diese Richtlinien in EU national rechtswirksam.
Die Befolgung dieser Richtlinien kann durch die Implementierung internationaler Standards und Guidance-Dokumente nachgewiesen werden. Die Medizinprodukterichtlinie der EU besagt, dass in der Software-Entwicklung für medizinische Geräte der neueste Stand der Technik implementiert werden soll. Dies empfiehlt implizit die Einhaltung der FDA-Richtlinien. FDA unterstreicht auch die Bedeutung der Software-Entwicklungsprozesse für das Design und Entwicklung der Software für Medizingeräte.
Üblicherweise existiert in der medizinischen Geräte-Software-Organisationen ein Netz an ISO- und IEC-Normen sowie FDA-Richtlinien, die befolgt werden müssen. ISO 13485 beschreibt die regulatorische Anforderungen an einen Qualitätsmanagement-System (QMS) für den Medizinbereich. ISO 14971 beschreibt ein Risikomanagementmodell, das in der Medizintechnikindustrie benutzt werden soll, und IEC 80002-1 gibt Hinweise, wie diese Anforderungen erreicht werden können. IEC 62304, die in Verbindung mit ISO 13485 verwendet werden kann, bietet einen notwendigen Rahmen für die Lebenszyklus-Prozesse zur sicheren Gestaltung und Wartung von medizinischer Geräte-Software. Obwohl IEC 62304 die Software als einen umfassenden Teil des Medizingerätesystems beachtet, werden die Anforderungen auf Systemebene nicht in dieser Norm betrachtet. Diese Anforderungen können in der Norm IEC 60601-1 gefunden werden.
In 2007 wurde in der Richtlinie für Medizinprodukte festgelegt, dass Stand-alone-Software (diese Software läuft auf einer vorbestimmten Hardware wie z.B. iPad) auch als ein medizinisches Gerät betrachtet werden kann. Die Norm IEC 82304-1 beschreibt das Verfahren, wie solche Gesundheits-Software zur Diagnose, Behandlung oder Überwachung eines Patienten entwickelt werden soll.
Es sollte auch beachtet werden, dass aufgrund der zunehmenden Bedeutung der Benutzerfreundlichkeit in der Medizinprodukte-Industrie die Organisationen auch die Norm IEC 62366 zur Gebrauchstauglichkeit einhalten sollten.
Leitlinien
Zusätzlich zu den verschiedenen, oben genannten Standards gibt die FDA eine Reihe von Leitlinien für Entwickler von Medizingeräte-Software heraus:
1. Allgemeine Grundsätze der Software-Validierung (GPSV),
2. Anleitung für die Inhalte,
3. Anleitung für die Industrie, FDA Gutachter und Konformität der OTS-Software (Off-The-Shelf). Dies beinhaltet die Anforderungen an die Zulassungsdokumentation bei Medizinprodukten, die OTS-Software beinhaltet.
Um die Hersteller und die Entwickler bei der Einhaltung der Normen zu unterstützen hat Celtic MedTech das »MDevSPICE«-Framework entwickelt. Dies integriert erprobte Vorgehensweisen zu mehreren internationalen Software-Entwicklungs- und Medizingeräte-Standards sowie FDA-Leitlinien in einen Rahmen.
MDevSPICE-Prozess-Assessments können für folgende Zwecke durchgeführt werden:
- um die Stärken und Schwächen der Software-Entwicklungsprozesse zu identifizieren,
- um sich auf die behördlichen Audits gegen internationale Standards vorzubereiten,
- um einen Software-Anbieter auszuwählen, dessenProzesse den Anforderungen internationaler Standards entsprechen, und/oder
- um Software-Prozesse über verschiedene Teams/Abteilungen hinweg zu standardisieren.
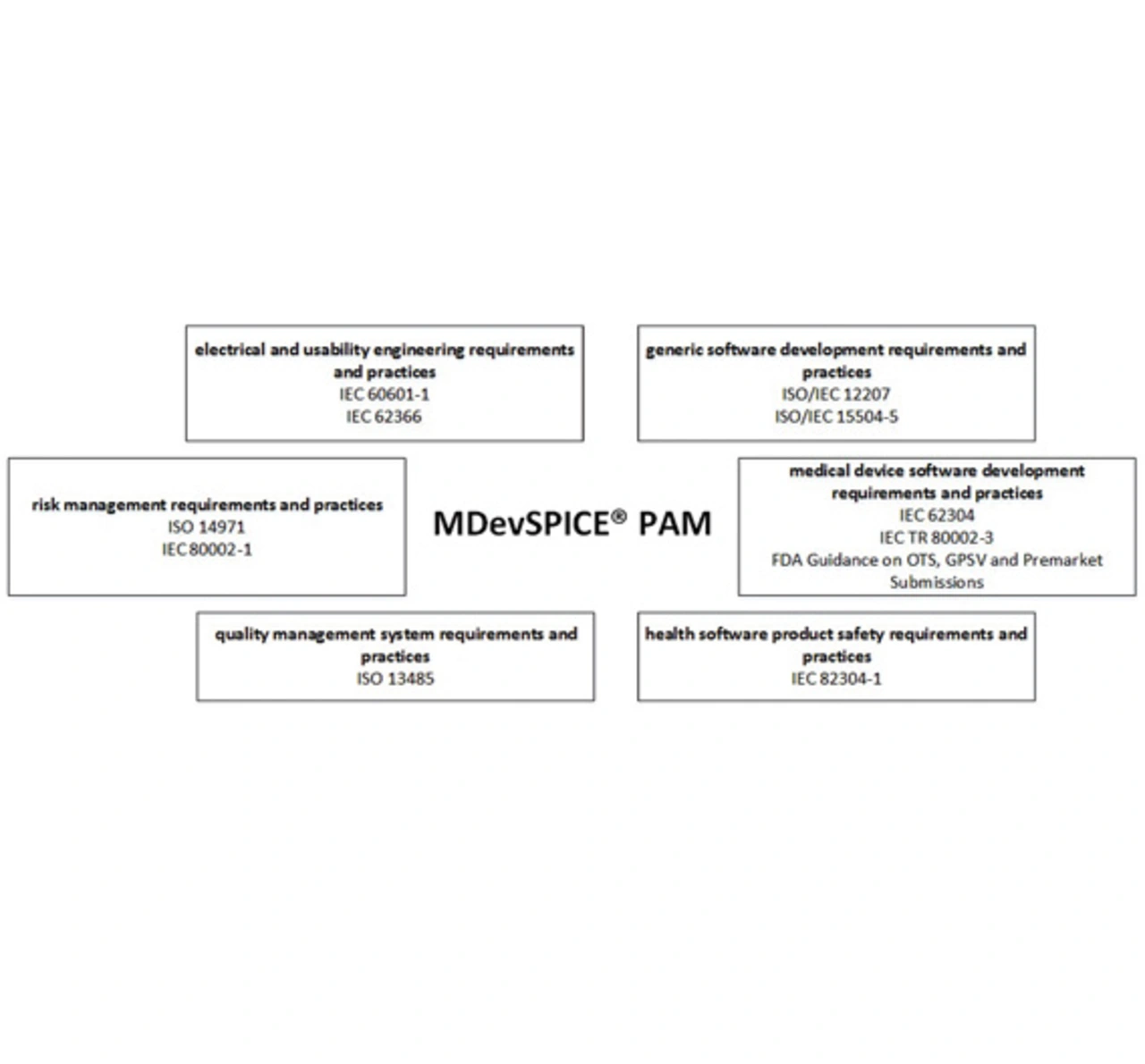
Das Framework besteht aus einem Prozessreferenzmodell, einem Prozessbewertungsmodell, einer Bewertungsmethode und Training und Zertifizierungsschemata. Es wurde sowohl durch Experten-Begutachtung als auch durch Assessments in der Industrie validiert. Es gibt verschiedene internationale Standards, die integriert sind (Bild 2); der Umfang der Prozess-Assessments kann individuell bestimmt werden. Es ist möglich, nur die Normen zu betrachten, die der Kunde als notwendig erachtet.
Über die Autoren:
Eva Breske arbeitet im Process & Quality Consulting bei Bosch Engineering und ist zertifizierter MDevSPICE-Assesor.
Dr. Marion Lepmets ist CEO von Celtic MedTech und
Dr. Fergal McCaffery ist Director des Regulated Software Research Center am Dundalk Institute of Technology.