Zur Blutprobe, bitte!
Sensorchip für mobile Diagnosegeräte
Wer während der Schweinegrippe-Epidemie im Krankenhaus eine leichte Erkältung oder Fieber bekam, wurde isoliert und auf Schweinegrippe untersucht, obwohl es sich um eine normale Erkältung gehandelt haben konnte. Weil es keine rasche Methode zum Nachweis der Krankheit gab, war die stundenlange Isolation mit Stress verbunden. Generell kann es Tage bis zur Indikation dauern, wenn die Diagnose auf dem Nachweis von Erbgut beruht. Ein Sensor auf Basis von Kohlenstoff-Nanoröhrchen könnte die Untersuchung deutlich beschleunigen.
Winzige Spuren der Erbsubstanz DNS konnten Forscher des Stuttgarter Max-Planck-Instituts für Festkörperforschung mit Hilfe neuer Sensoren aus Kohlenstoff-Nanoröhrchen nachweisen. Weil die Sensoren auf spezifische DNS-Sequenzen ansprechen, lassen sie sich prinzipiell für die schnelle Untersuchung von Blutproben verwenden. Der Nachweis von DNS ist notwendig, um unterschiedliche Krankheiten wie Infektionen durch Viren oder Mikroben zu diagnostizieren. Die Nanosensoren sind so empfindlich, dass die DNS anders als bislang nicht mehr zeitaufwändig aufkonzentriert oder markiert werden muss.
Eine Routinemethode für die Herstellung ermöglicht prinzipiell eine schnelle Serienfertigung. Das Endpro
Oft dauert es aber Tage, bis die Diagnose vorliegt, nämlich dann, wenn die Diagnose auf dem Nachweis der Erbsubstanz DNS beruht. Denn die DNS des Krankheitserregers liegt nur in Spuren im Blut vor, sodass sie durch die üblicherweise verwendeten optischen Methoden nicht detektiert werden kann. Die gesuchten DNS-Moleküle werden deshalb mit Hilfe der so genannten Polymerase-Kettenreaktion (Polymerase Chain Reaction, PCR) vervielfältigt und anschließend mit einem fluoreszierenden Molekül markiert. Erst dann ist ein Fluoreszenzmikroskop in der Lage, die Fremd-DNS nachzuweisen.
Unkonzentriert
Mit dem Sensorchip der Forscher um Kannan Balasubramanian vom Max-Planck-Institut für Festkörperforschung erübrigt es sich hingegen, die DNS aufzukonzentrieren. Denn der Chip weist die Erbsubstanz nicht mithilfe eines Mikroskops, sondern mit sehr empfindlicher Elektronik nach. Sein Herzstück sind Kohlenstoff-Nanoröhrchen. Diese bestehen aus einem aufgerollten Netz von Kohlenstoff-Atomen.
Die Röhrchen mit weniger als einem Nanometer Durchmesser zeichnen sich durch eine sehr gute Leitfähigkeit aus. Sie eignen sich als hochsensitive Sensoren, weil sich ihre Leitfähigkeit bereits durch geringe Störungen verändert - etwa wenn sich ein Molekül an das Röhrchen bindet.
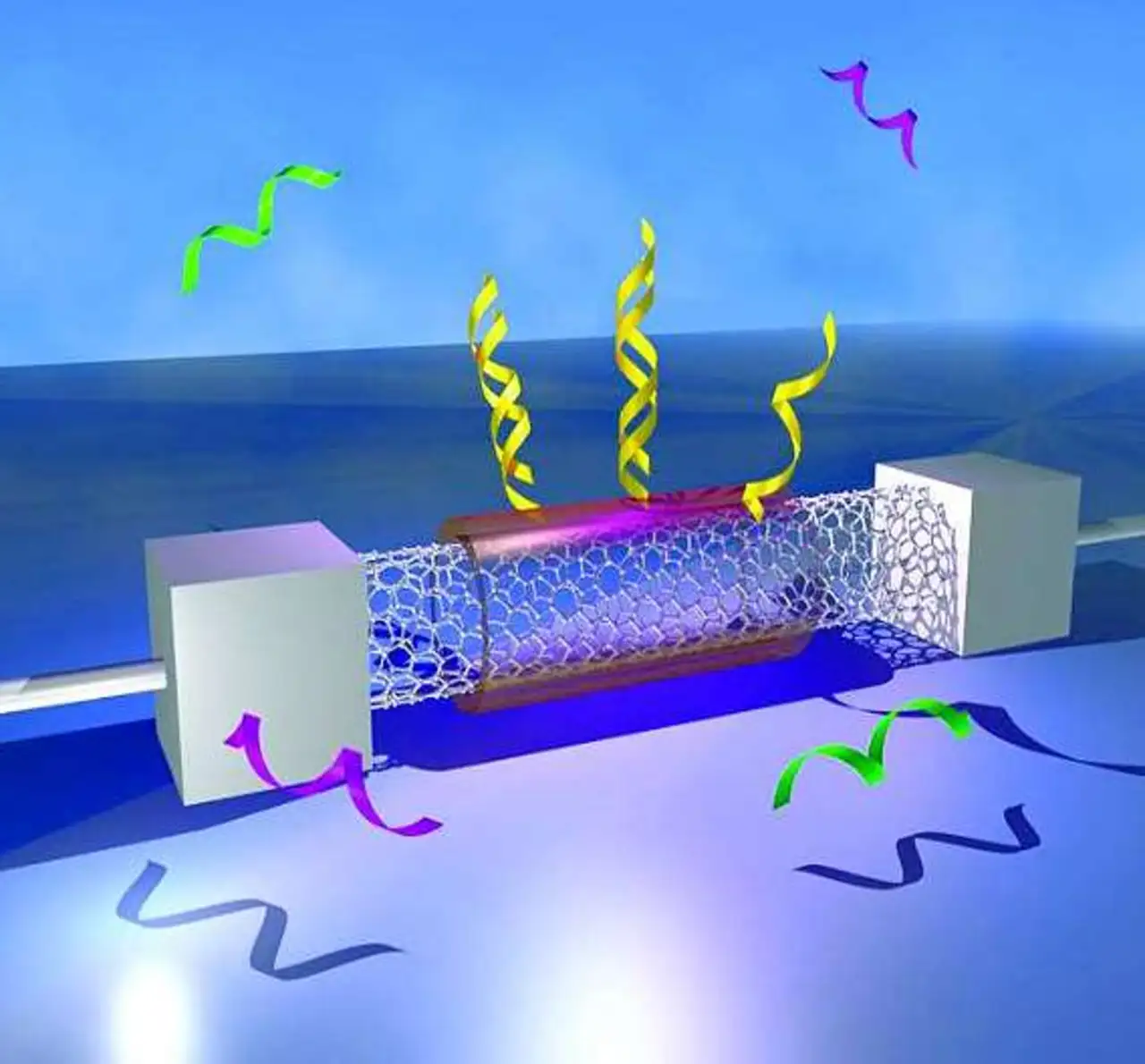
Der Grund hierfür ist, dass die Nanoröhrchen keine Atome in ihrem Innern aufweisen. Alle Kohlenstoffatome sitzen an der Oberfläche. Daher beeinflusst eine Störung an der Oberfläche das gesamte Röhrchen. Doch Empfindlichkeit allein ist erst die halbe Miete. Da in einer biologischen Flüssigkeit außer der gesuchten noch viele weitere DNS-Moleküle herumschwimmen, muss der Sensor gewissermaßen blind gegen diese nicht interessierenden Moleküle gemacht werden. Die Selektivität, also die Fähigkeit des Sensors, nur eine bestimmte DNS-Sequenz zu detektieren, erreichen die Forscher, indem sie vor der Messung bestimmte DNS-Moleküle an das Nanoröhrchen binden.
Diese können sich jeweils mit dem gesuchten DNS-Molekül - und nur mit diesem - zu einer DNS-Doppelhelix verbinden. Die beiden Hälften passen sozusagen zusammen wie Schlüssel und Schloss. Wenn die beiden DNS-Moleküle sich verbinden, beeinflusst dies das Nanoröhrchen ebenso, als würde sich ein Molekül direkt an seine Oberfläche binden: Die Elektronendichte auf dem Kohlenstoff-Nanoröhrchen (Carbon Nanotube, CNT) verändert sich und damit dessen Leitfähigkeit.
Das funktioniert nicht nur mit DNS, denn auch andere Biomoleküle besitzen eine Art Kompagnon, ein zweites Molekül, in das sie hineinpassen wie besagter Schlüssel ins Schloss. Auf der Oberfläche von Fremdkörpern im Blutstrom befinden sich etwa Proteine, so genannte Antigene, die der Organismus mithilfe von Antikörpern bekämpft. Ein Antikörper ist ein Protein, das sich wie eine Gussform über das Antigen stülpen lässt.
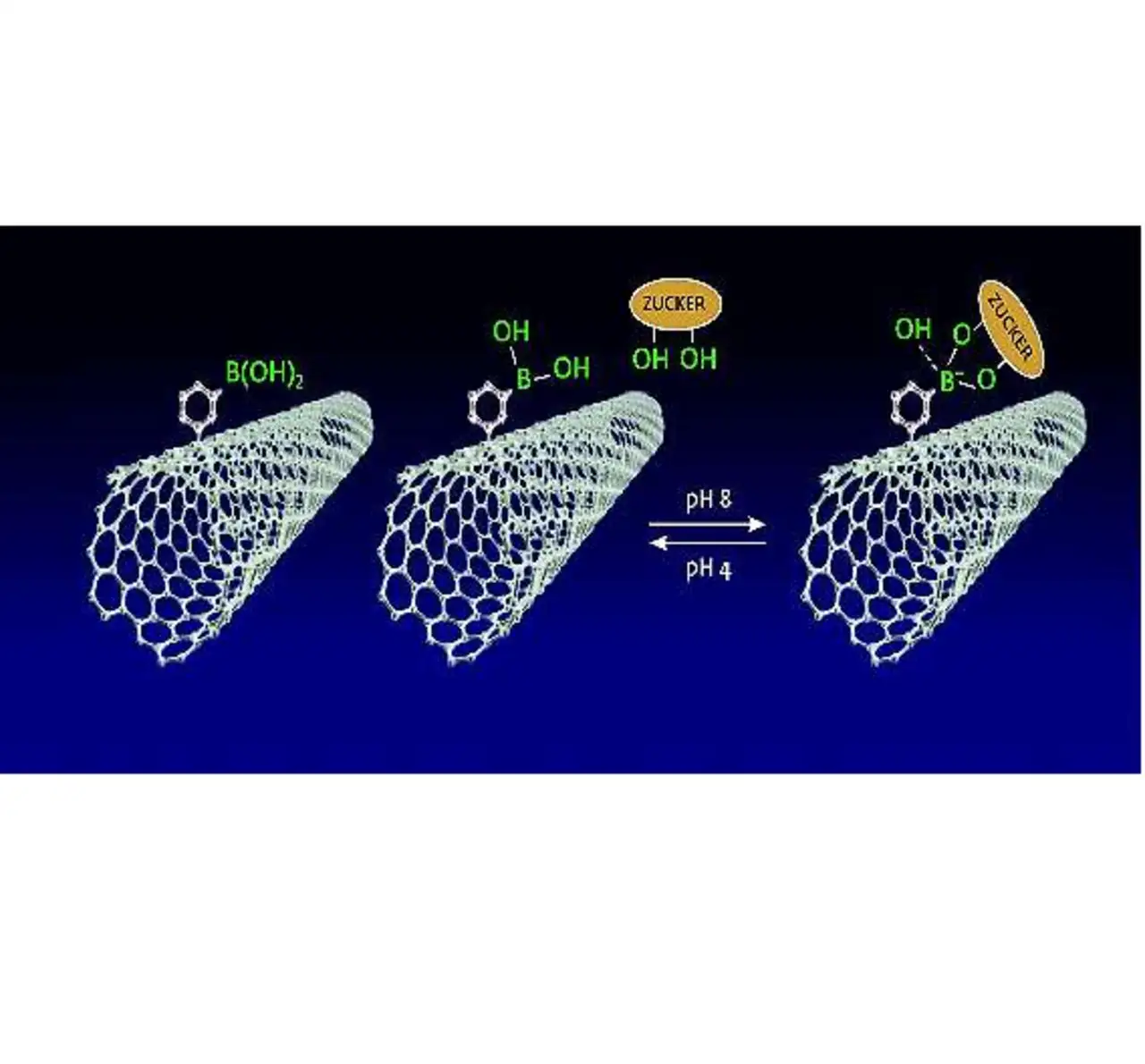
Ein Molekül, das selektiv ein gesuchtes Molekül an sich bindet, heißt Rezeptor. »Wir machen die CNTs selektiv, indem wir einen Rezeptor, etwa für Blutzucker, an sie heften«, erklärt Balasubramanian. Die Rezeptoren erhöhen an sich schon den Widerstand des Nanoröhrchens. Den erhöhten Widerstand erklären die Forscher zur neuen Nulllinie. Bindet sich nun der gesuchte Stoff, der Analyt, an den Rezeptor, verändert sich die Verteilung der Elektronen auf dem Kohlenstoffröhrchen noch stärker als durch den Rezeptor allein, und die Leitfähigkeit sinkt weiter.
Um einen Chip zu bauen, der in einem Blutstropfen nach mehreren Analyten gleichzeitig sucht, um etwa ein komplettes Blutbild in einem Test zu erstellen, sind mehrere mit Kohlenstoff-Nanoröhrchen verbundene Elektrodenpaare notwendig, zwischen denen der Stromfluss separat gemessen werden kann.
Die Röhrchen zwischen den Elektroden müssten jeweils unterschiedliche Rezeptoren tragen.
Wie kommen die verschiedenen »Anhängsel« aber gezielt auf das Nanoröhrchen? Den Chip in eine Lösung zu tauchen, die alle Rezeptoren auf einmal enthält, wäre sinnlos.
Denn die Rezeptoren würden wahllos mit den Kohlenstoffröhrchen reagieren. Das Team fand einen erstaunlich einfachen Weg, die Rezeptoren gezielt zu platzieren.
Elektrochemie als Schlüssel
Die Forscher tauchen einen Chip mit vielen Elektrodenpaaren, die sie bereits mit Nanoröhrchen verbrückt haben, in die Lösung eines Rezeptors. Nun berühren sie eine der Elektroden mit der Spitze einer elektrisch geladenen Metallnadel, sodass Elektronen von der Nadel in das Röhrchen und von dort in den Rezeptor fließen. Der elektrische Reiz macht den Rezeptor besonders reaktionsfreudig, und er verbindet sich sehr leicht mit dem Röhrchen, das ihm den Ladungsschub gegeben hat. Eine andere Rezeptorlösung sorgt für die Spezialisierung des nächsten Sensors. Damit sind jedoch noch nicht alle Probleme gelöst. Denn die Natur der Kohlenstoff-Nanoröhrchen stellt eine weitere Hürde dar: Nanoröhrchen ist nicht gleich Nanoröhrchen!
Je nachdem, welchen Winkel die Waben des Kohlenstoffgitters mit der Röhrenachse bilden, leiten die Röhrchen Strom wie ein Metall oder wie ein Halbleiter. Bei ihrer Herstellung entsteht gewöhnlich ein Gemisch aus metallischen und halbleitenden Röhrchen. Prinzipiell lassen sich zwar beide Sorten verwenden, um Sensoren zu bauen, doch die metallischen Röhrchen brauchen eine Sonderbehandlung: Sie reagieren nur auf einen Analyt, wenn sie feste chemische Bindungen, so genannte kovalente Bindungen, mit ihren Rezeptoren eingehen. Die Forscher um Balasubramanian suchten also nach einer Methode, die das sicherstellt. Eine solche fanden sie ebenfalls in der Elektrochemie.
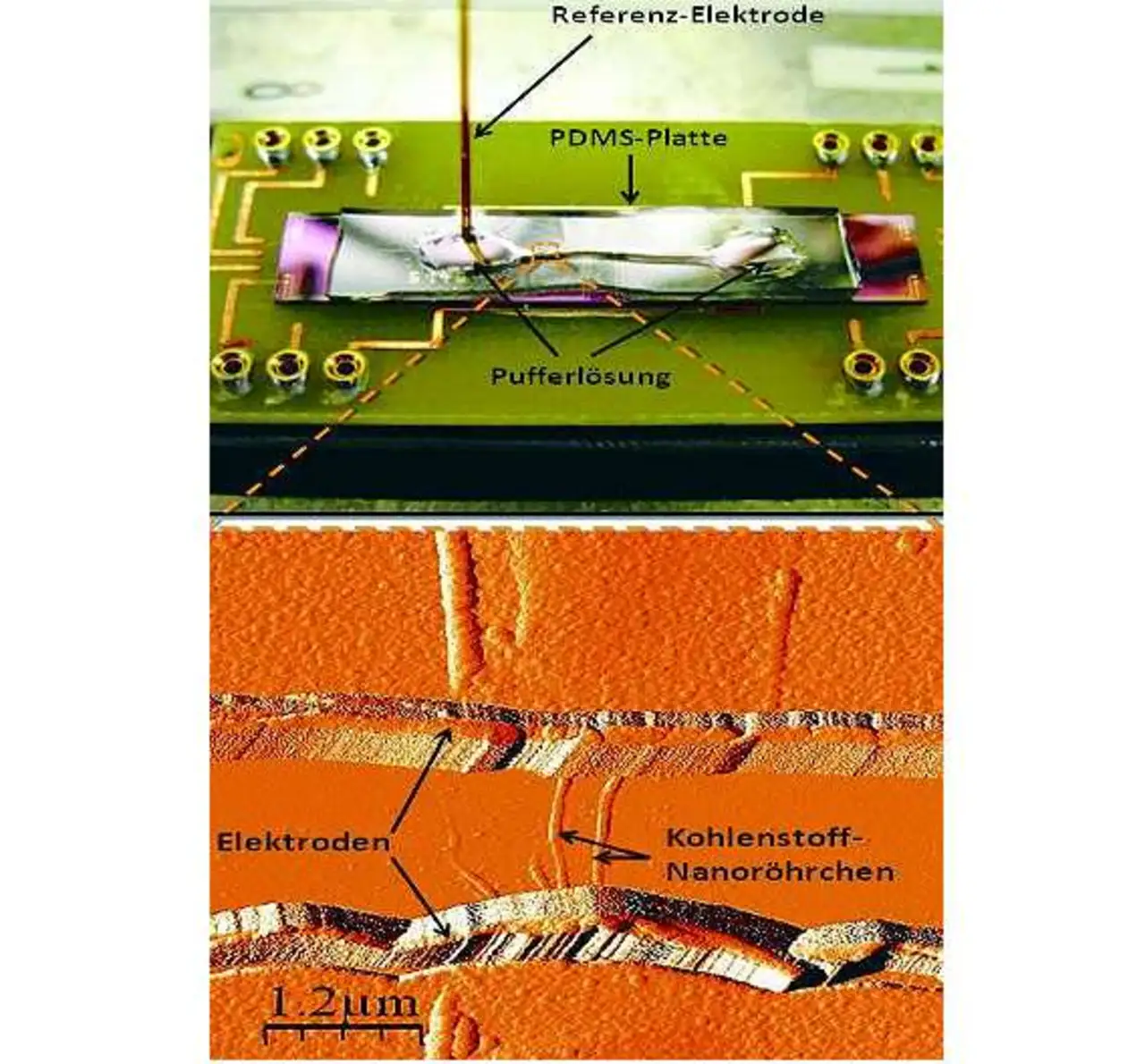
Mit ihr lässt sich nämlich kontrollieren, ob bei der Reaktion zwischen CNT und Rezeptor Elektronen zugeführt oder entzogen werden, ob es sich also um eine Reduktion oder eine Oxidation handelt. »Wenn wir den Rezeptor mit einem Diazoniumsalz versehen und die Reaktion als Reduktion ablaufen lassen, dann entsteht zwischen dem Rezeptor und dem metallischen CNT eine kovalente Bindung.« In den bislang gebauten Chips verbinden mehrere der vorbehandelten Kohlenstoffröhrchen zwei Elektroden miteinander. Die Elektroden bilden einen wenige tausendstel Millimeter breiten Kanal, durch den die zu untersuchende Lösung fließt und in Kontakt mit den Nanoröhrchen tritt.
Die Elektroden lassen sich an ein Messgerät anschließen, das die Änderung der Leitfähigkeit bestimmt. Durch eine chemische Prozedur lösten die Forscher die DNS-Moleküle nach der Messung wieder von den Nanoröhrchen ab, sodass der Sensor wiederverwendet werden konnte. Eine Referenzelektrode macht die Messergebnisse reproduzierbar und stabil. Bei einem ersten Versuch mit einer künstlichen Lösung aus synthetischen DNS-Molekülen fanden die Stuttgarter Forscher eine so geringe Spur der gesuchten Moleküle, wie sie bislang kein Sensor nachweisen konnte. In Zahlen ausgedrückt wies der Sensor 2000 Moleküle der gesuchten DNS in 30 Mikrolitern Lösung nach. Das entspricht einer 100-attomolaren DNS-Lösung (ein Attomol entspricht dem milliardsten Teil eines milliardstel Mols).
»Wir glauben, dass die Methode soweit verfeinert werden kann, dass noch weit geringere Konzentrationen, im Extremfall sogar einzelne Moleküle nachgewiesen werden können«, sagt Kannan Balasubramanian. Die nächste Hürde, welche die Forscher nehmen wollen, ist die Untersuchung von echten biologischen Flüssigkeiten. Der Erfolg des vom Bundesministerium für Bildung und Forschung geförderten Teams beruht auf langjähriger Forschungsarbeit. »Diese Methode ist prinzipiell skalierbar«, betont Balasubramanian. Das heißt die Sensor-Chips könnten in Serie gefertigt werden. Der Forscher glaubt daher, dass die Nanosensoren aus Stuttgart einst für handygroße mobile Diagnose-geräte genutzt werden könnten, um im Feld oder in Krankenhäusern zuverlässig und schnell Krankheitserreger zu identifizieren.
Die industrielle Fertigung ist einigermaßen kompliziert, aber kein unlösbares Problem. Der erste Schritt ist der einfachste: Platinelektroden auf einen Siliziumwafer zu setzen ist mit Standardmethoden der Halbleiterfertigung möglich. Doch dann beginnt das technische Neuland: Zwischen jedes Elektrodenpaar muss nun mindestens ein CNT gelangen, damit keine toten Sensoren entstehen. Denn die Industrie erwartet ein Verfahren, das möglichst keinen Ausschuss produziert. Das Aufbringen der CNTs ähnelt einer Jagd mit der Schrotflinte: Wie ein Jäger eine Garbe von Projektilen auf die Beute schießt und hofft, dass eines schon treffen wird, versuchen die Forscher Nanoröhrchen zwischen den Elektroden zu platzieren.
Der Schrotladung entspricht die Mischung − eine Dispersion − von Kohlenstoff-Nanoröhrchen und Wasser. Als Gewehr greifen die Forscher zu einer Methode namens Dielektrophorese. Ein ungleichmäßiges elektrisches Feld, das in der Lösung erzeugt wird, treibt die Nanoröhrchen zu den Elektroden. Durch Zufall treffen einige so zwischen die Elektroden, dass sie genau in die Lücke passen. Da sich die Nanoröhrchen in der Dis-persion nicht gleichmäßig verteilen, sondern gerne verklumpen, gelangt nicht zu jedem Elektrodenpaar ein Röhrchen. »Bis vor Kurzem konnte man mit der Dielektrophorese nur rund 30 bis 60 Prozent Durchsatz erreichen«, räumt Balasubramanian ein. Mindestens ein Drittel der Sensoren war also tot.
»Wir haben dann aber einen Weg gefunden, eine Dispersion ohne verklumpte Nanoröhrchen zu produzieren«, erklärt der Forscher. Dann verteilen sich die Röhrchen so gleichmäßig, dass garantiert mindestens eins zwischen jedem Elektrodenpaar landet. Auf diese Weise lassen sich routinemäßig 100 Prozent Durchsatz erreichen. Momentan können auf einem Wafer mit 10 cm Durchmesser zuverlässig bis zu 40 Sensoren ohne Ausschuss hergestellt werden. Damit haben die Nanosensoren einen wichtigen Schritt in Richtung Serienproduktion getan.
Notwendige Theorie
Bevor die Nanosensoren in der Praxis eingesetzt werden können, warten allerdings noch wichtige Aufgaben auf das Stuttgarter Team. Zwar hat es bewiesen, dass die Nanosensoren funktionieren und in industrienahen Prozessen hergestellt werden können.
Aber die Forscher haben die physikalischen Prozesse, die sich bei der Signalentstehung auf den Nanoröhrchen abspielen, noch nicht im Detail verstanden. »Wir brauchen ein theoretisches Modell für die Abhängigkeit des Sensorsignals von der Analyt-Konzentration«, meint Balasubramanian. Nur dann lasse sich nachweisen, dass man tatsächlich misst, was man vorgibt zu messen.
Damit es die Diagnosegeräte zur Marktreife bringen, müssen die Wissenschaftler nicht zuletzt über ihren Tellerrand blicken. »Es reicht nicht, einen Nanosensor zu bauen«, sagt Balasubramanian. »Wir müssen uns schon heute fragen, in welchem Gerät unser Sensor morgen arbeiten wird.«
Die Technik müsse es erlauben, später Schnittstellen hinzuzufügen.

