Batterien und Akkus
Forschungsfabrik für Lithium-Ionen-Akkus
Fortsetzung des Artikels von Teil 1
Zerstörungsfreie Prüfung mit Neutronen
Die fertigen Zellen durchlaufen dann ausgiebige Tests. Bei schleichender Degradation oder plötzlichem Totalausfall will man verstehen, was für Vorgänge da genau ablaufen. Dazu stehen modernste Untersuchungsmethoden zur Verfügung, um die die Garchinger Forscher von anderen beneidet werden: In wenigen hundert Metern Entfernung vom Institut arbeitet der Forschungsreaktor FRM-II, eine hochmoderne, leistungsfähige Neutronenquelle [3]. Damit lassen sich viele Analysen durchführen, die mit anderen Methoden nicht möglich sind. Der große Vorteil: Sie funktionieren zerstörungsfrei. Man kann die Zelle während Auflade- und Entladevorgang untersuchen und in feinsten Details analysieren, ohne sie zu öffnen und dadurch die Vorgänge zu verfälschen.
Wie das im Einzelnen abläuft, erläutert Dr. Ralph Gilles vom FRM-II. Die aus dem Reaktor kommenden Neutronen durchlaufen das zu untersuchende Objekt, wobei sie in ihrer Richtung abgelenkt und in ihrer Energie geschwächt werden. Detektoren im Halbkreis um die Probe zeigen Maxima bei bestimmten Winkeln. Winkel und Intensität erlauben Rückschlüsse auf Material und Struktur. Die Auflösung ist hier nicht ganz so fein wie mit Röntgen-Computertomografie. Gilles: „Wir haben LiC12 beim Laden, dann plötzlich wird dieser Reflex kleiner, LiC6 entsteht. So können Sie wirklich in Operando den Ladungsvorgang der Batterie beschreiben.“
Die „Belichtungszeit“ liegt bei etwa 25 Sekunden. Sehen kann man damit die Art der Atome, die chemische Zusammensetzung, den Lithium-Ionen-Transport, Porositäten in Batteriekomponenten, Verunreinigung von Elektroden, Ladestand und vieles mehr. So hat man einen der Degradationseffekte schon identifiziert: Einige Lithium-Ionen lagern sich an der Anode an und hängen daran fest. Weil dann weniger für den Transport zur Verfügung stehen, sinkt die Kapazität – auf z.B. nur noch 80 % nach 1000 Zyklen. Der Prozess ist noch nicht vollständig verstanden. Er hängt von der Temperatur ab, bei 25 °C ist er stärker als bei 50 °C.
Die Superbatterie lässt auf sich warten
Die kurze Reichweite der meisten derzeitigen Elektroautos von nur etwa 150 km hält viele Interessenten immer noch vom Kauf ab. Für eine Erhöhung kann man die Batterie im Fahrzeug nicht mehr wesentlich größer machen – sie würde zu schwer und auch zu teuer. So bleibt nur der Weg zu höherer Energiedichte. Die kommt auch bei den besten Batterietypen noch nicht entfernt an die von Benzin heran. So ist die Forschung höchst aktiv, um sie immer noch weiter zu steigern. Vom Material her wären im Prinzip 450 Wh/kg möglich. Aber es kommt das Gehäuse dazu, außerdem Zellenverbinder, Batterieüberwachungssystem usw. In der Praxis lassen sich 200 Wh/kg kaum überschreiten. Die Batterie im Elektroauto „Tesla“ kommt auf 120 Wh/kg. Im Vergleich dazu erreicht Benzin fast 13 kWh/kg.
Parallel dazu sind alternative Materialien in Untersuchung. Die Aufnahmefähigkeit der Graphit-Anode hat ihre Grenzen: Auf minimal sechs Kohlenstoff-Atome kann ein Lithium-Atom kommen, mehr geht nicht. Bis zu zehnmal mehr Lithium aufnehmen könnte Silizium in einer Form mit großer Oberfläche, etwa als Pulver. Aber es hat ein Problem: Es quillt dabei sehr stark auf; die Zelle muss dafür Raum bieten, damit sie nicht platztechnisch schwierig zu realisieren. Eine Alternative könnte eine filzartige Struktur aus einem geeigneten Trägermaterial sein, beispielsweise dünne Kohlenstoff-Fasern, auf denen das Silizium in Form von Nanopartikeln abgeschieden wird. Grundlagenforschung in dieser Richtung läuft etwa an der Universität Bayreuth am Lehrstuhl für Werkstoffverarbeitung (Prof. Dr. Monika Willert-Porada, [4]). Eine Alternative könnte möglicherweise eine Verbindung von Silizium und Bor sein, entwickelt am Lehrstuhl für Anorganische Chemie der TU München. Dieses Material hat eine völlig neue Gerüststruktur. In Lithium-Borsilicid (LiBSi2) sind die Atome tetraederförmig miteinander verbunden, ähnlich wie die Kohlenstoff-Atome im Diamanten. Doch im Unterschied dazu bilden sie zusätzlich Kanäle aus, in die sich prinzipiell Lithium ein- und wieder auslagern lässt. Es muss sich noch herausstellen, ob man dieses Material wirtschaftlich herstellen und verarbeiten kann und wie das Langzeitverhalten aussieht. Damit werden noch etliche Jahre ins Land gehen.
Immer wieder berichten Schlagzeilen über „Wunderbatterien“ mit angeblich vielfach höheren Energiedichten als die derzeitigen. Man darf nicht glauben, diese würden schon gleich morgen zur Verfügung stehen. Bei genauerer Nachfrage zeigt sich meist, dass diese entweder überhaupt nur auf dem Papier berechnet wurden und noch gar nicht real aufgebaut worden sind, oder, wenn doch, die Labormuster diese Werte noch längst nicht erreichen. Zudem ist bei all diesen Neuentwicklungen die geforderte Lebensdauer – viele tausend Lade-/Entladezyklen – überhaupt noch nicht bestätigt. Viele geben schon nach wenigen Zyklen den Geist auf. Um die Degradationsvorgänge zu verstehen und zu überwinden, ist noch jahrelange Grundlagenforschung nötig. Oft sind sehr viele Zusatzaggregate um die Zelle herum erforderlich, so dass die gesamte Batterie zu einem hochkomplexen System wird und der erhoffte Gewinn an Energiedichte großenteils wieder aufgefressen wird. An eine Serienproduktion ist in absehbarer Zeit nicht zu denken. Letztlich sind das alles Projekte über Jahrzehnte. Man erinnere sich daran, dass die heute in Produktion befindlichen Lithium-Ionen-Akkus auch so viel Zeit gebraucht haben.
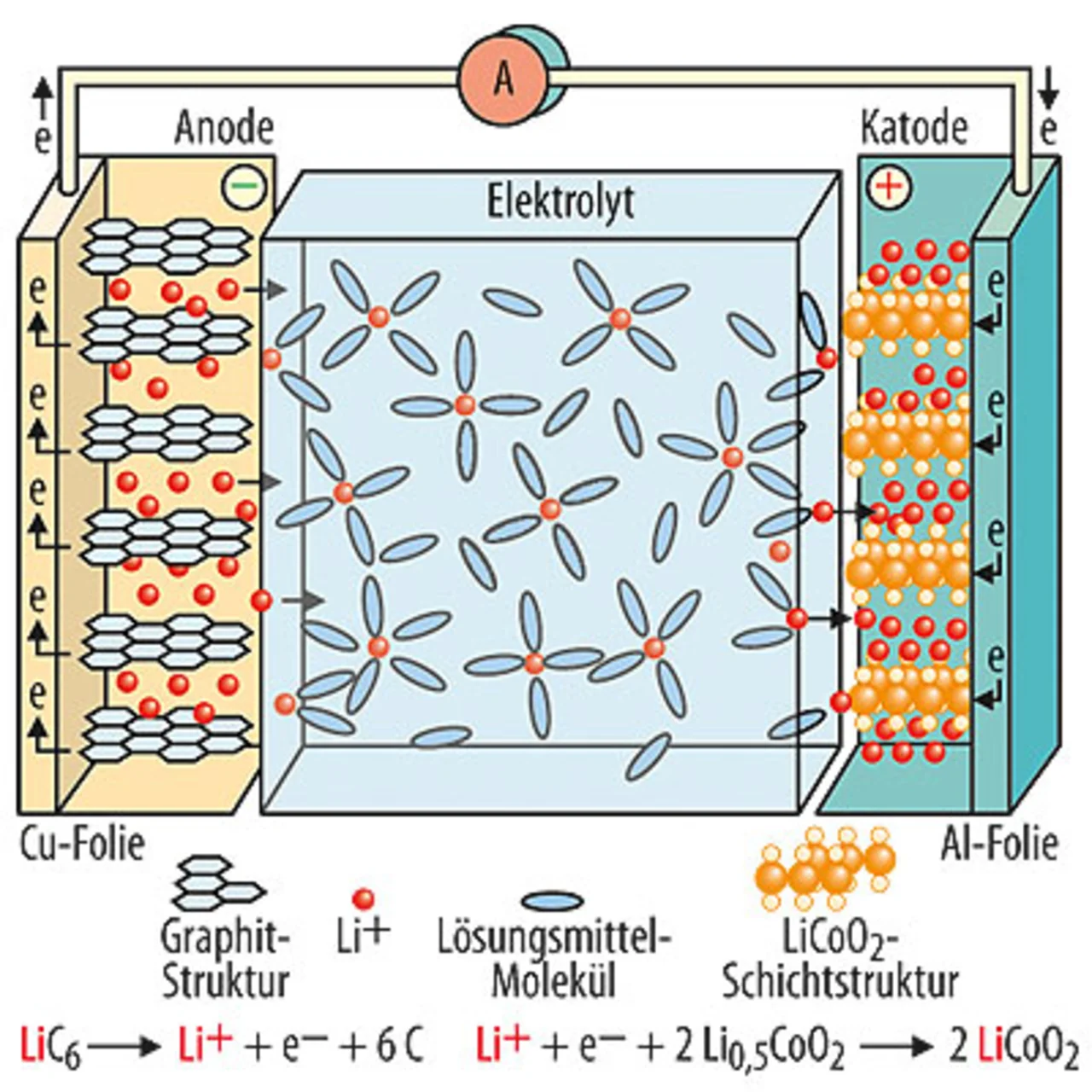
Die Elektrochemie dafür wurde Mitte der 70er Jahre erfunden (übrigens an der TU München, dann hier aber nicht mehr weiter verfolgt), die ersten käuflichen Exemplare gab es 1990 von Sony, der Marktdurchbruch bei Kleingeräten begann so richtig erst nach 2000. Prof. Dr. Hubert Gasteiger, Lehrstuhl für Technische Elektrochemie an der TU München [2] , berichtet von einigen grundsätzlich neuen Ansätzen mit anderer Chemie. Im Prinzip wären Zellen mit Spannungen bis 5 V möglich. Gegenüber den derzeitigen mit 4 V wäre das ein Energiegewinn von 25 %. Diese Zellen kennt man schon seit zehn Jahren, deren Problematik liegt aber in der Lebensdauer. Um die zu verlängern, sucht man nach geeigneten Additiven für die Elektrolyte. Hier ist z.B. BASF sehr stark engagiert.
Im Prinzip wären Zellen mit Spannungen bis 5 V möglich. Gegenüber den derzeitigen mit 4 V wäre das ein Energiegewinn von 25 %. Diese Zellen kennt man schon seit zehn Jahren, deren Problematik liegt aber in der Lebensdauer. Um die zu verlängern, sucht man nach geeigneten Additiven für die Elektrolyte. Hier ist z.B. BASF sehr stark engagiert.
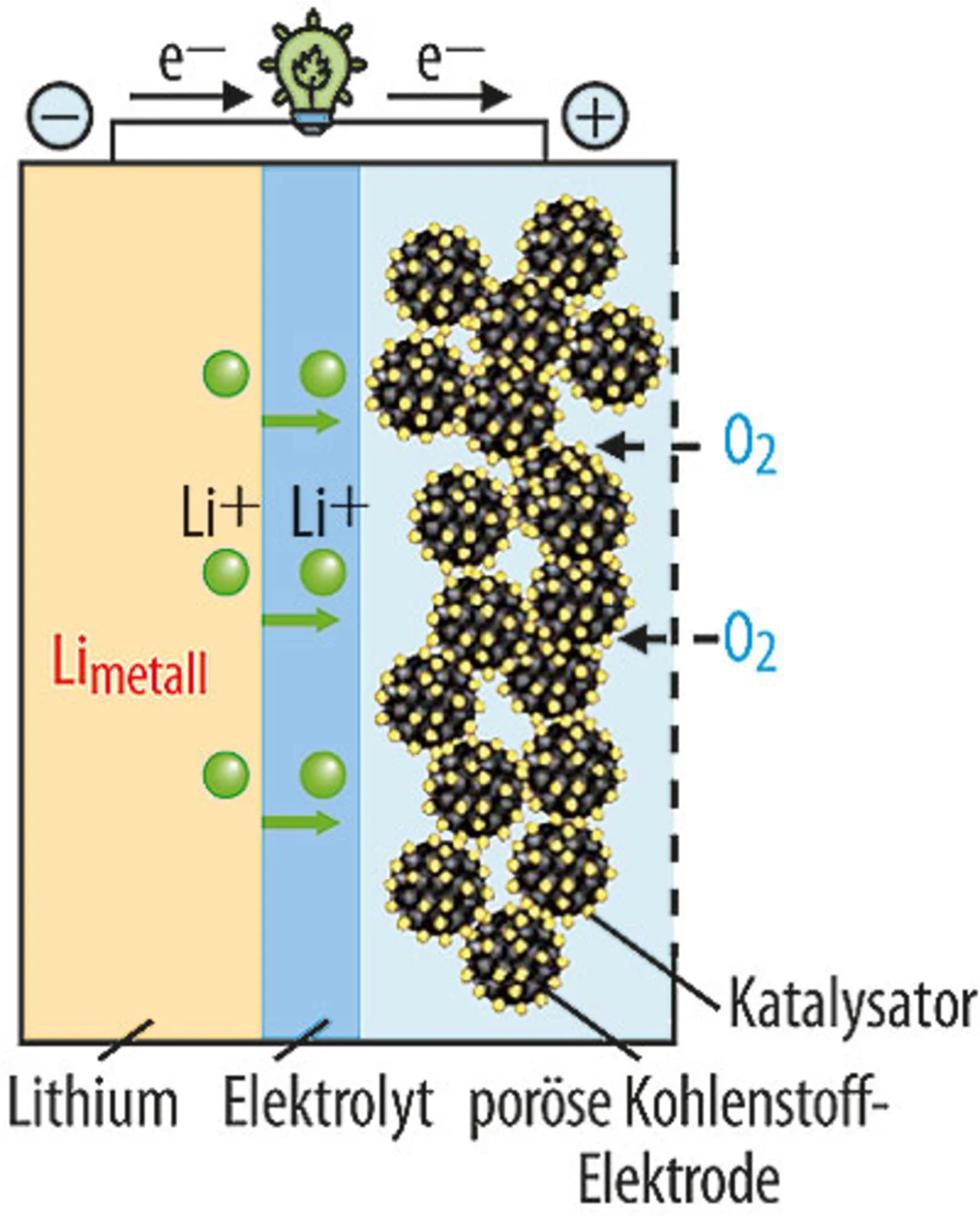
Auch Zellen mit reinem Lithium wurden schon ausgiebig untersucht. Laut Prof. Gasteiger sind bisher alle Versuche damit gescheitert. Der Wunschtraum ist, von den derzeitigen Gaststrukturen wegzukommen – von Graphit und Oxid, die beide viel wiegen. Eine riesige Energiedichte, fast so hoch wie von Benzin, verspricht das System Lithium-Luft (Bild 4) – rein theoretisch. Doch die praktischen Probleme sind immens.
Viel geforscht wird auch am System Lithium-Schwefel. Gasteiger: „Die Gleichung ist ganz einfach, aber die Details sind schrecklich schwierig. Es entstehen hier außer Lithium-Sulfid (Li2S) auch sehr viele Zwischenprodukte, Lithium-Polysulfide wie Li2S2, Li2S4 und weitere, die lösen sich im Elektrolyten. Sie können auf die andere Elektrode rüberfliegen und machen einen internen chemischen Kurzschluss.“ Es ist noch lange nicht sicher, ob eine Lithium-Schwefel-Batterie jemals in Serie gehen wird.
Auch viele völlig andere Systeme ohne Lithium sind Gegenstand intensiver Forschung, etwa Zink-Luft (Bild 5). Während Primärzellen mit sehr hoher Energiedichte seit Jahrzehnten in Massenproduktion sind, stecken wiederaufladbare noch tief in der Forschung, z.B. an der Universität Bayreuth [5].
Kurz- bis mittelfristig dominieren also noch die derzeitigen Lithium-Ionen-Zellen; sie werden in ihren Eigenschaften ständig besser. Und – hoffentlich bald – auch billiger.
Literatur
[1] www.iwb.tum.de/PM_Forschungsproduktionslinie-p-1060842.html
[2] www.tec.ch.tum.de
[3] www.frm2.tum.de
[4] www.lswv.uni-bayreuth.de/de/index.html
[5] www.zet.uni-bayreuth.de/de/Energietagung/Vortraege/Willert-Porada_Batterien.pdf
- Forschungsfabrik für Lithium-Ionen-Akkus
- Zerstörungsfreie Prüfung mit Neutronen





