Akku-Technik
Gefährdungspotenzial von Li-Ionen-Zellen
Fortsetzung des Artikels von Teil 1
Was passiert beim Überladen und Tiefentladen?

Um den zeitlichen Verlauf der Gasentwicklung und die Zusammensetzung der anfangs gebildeten Gase zu untersuchen, wurden in Zusammenarbeit mit dem Fraunhofer-Institut für Chemische Technologie (ICT, [1]) in Pfinztal Überlade- und Tiefentladeversuche vorgenommen. Die Temperaturentwicklung in den Li-Ionen-Zellen wurde durch jeweils zwei Temperaturfühler aufgezeichnet.
Im Überladeversuch wurden vollgeladene 2,2-Ah-Lithium-Ionen-Polymerzellen (Ladeschlussspannung 4,2 V) mit einem konstanten Strom von 4,4 A (2C) innerhalb von 5 min bis auf 4,9 V überladen. Bild 2 illustriert, wie sich die Polymerzellen - sie haben kein festes Metallgehäuse - infolge der entstehenden Gase aufblähen. Gleichzeitig stieg die Temperatur der Zellen von 20 °C auf 39 °C.
Im Tiefentladeversuch wurden entladene Li-Ionen-Zellen (Entladeschlussspannung 2,8 V) mit einem konstanten Strom von 1C bis in den Bereich der Spannungsumkehr tiefentladen. Die Zelle wurde hierzu mit einem Netzteil (Ausgangsspannung 12 V) in Reihe geschaltet und mit einer hierzu parallelgeschalteten elektronischen Last entladen (Bild 3).
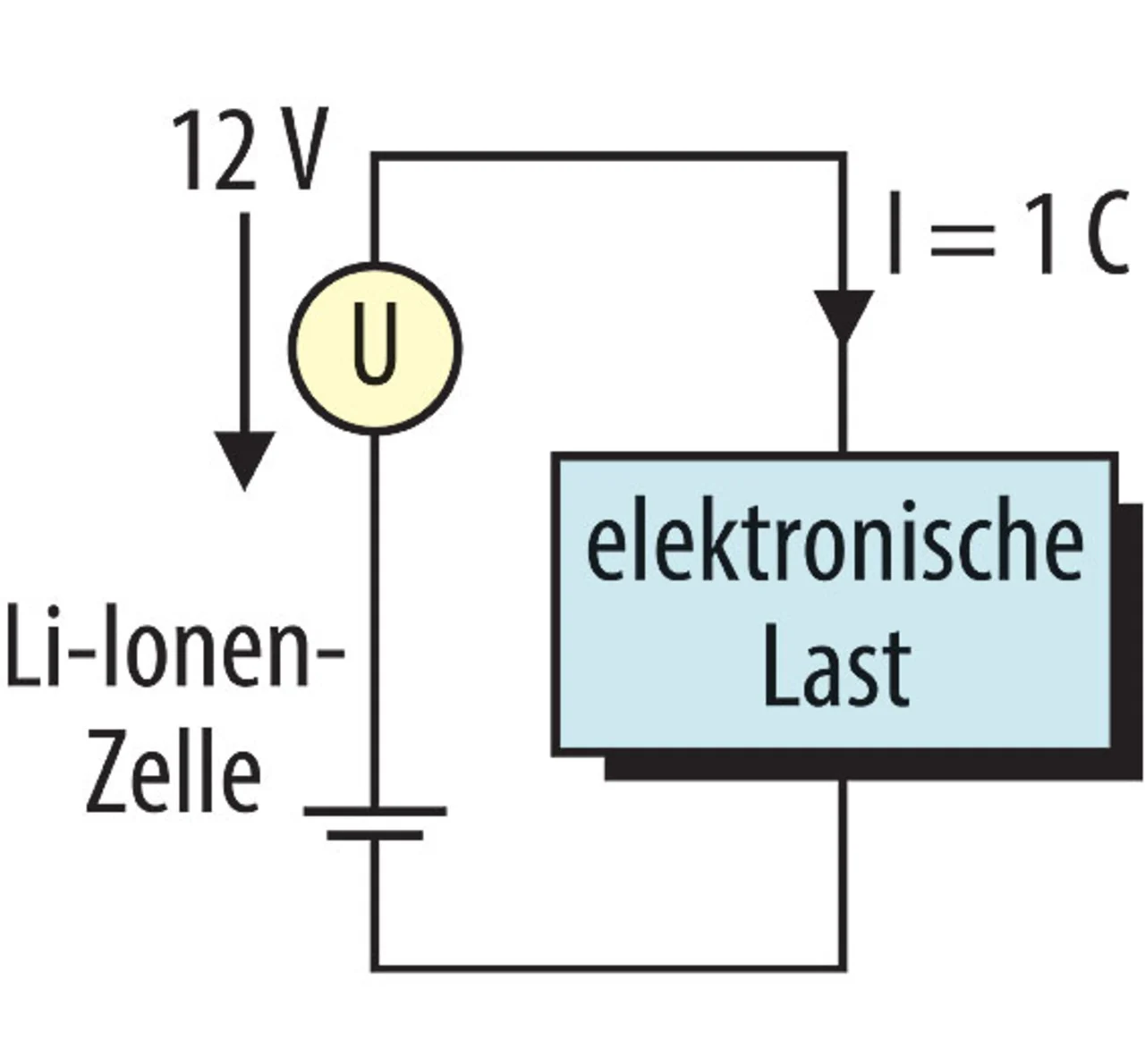
Auch hier blähten sich die Zellen infolge entstehender Gase auf und die Temperatur der Zellen stieg um 29 °C.
Zur Entnahme der Gasproben wurde Silikonkleber als Septum auf die Oberfläche der Pouchzellen aufgetragen und das Gasgemisch über eine feine Kapillarspritze entnommen. Zur Sicherheit wurden die überladenen Zellen davor auf 0 V entladen.
Zu der qualitativen und quantitativen Analyse wurde ein Gaschromatograph in Kombination mit einem Wärmeleitfähigkeitsdetektor (TCD-Spek-trum) und einem Flammenionisationsdetektor (FID-Spektrum) eingesetzt. Durch den vorangeschalteten Gaschromatographen wurden die Gase sauber aufgetrennt, so dass diese mit den nachgeschalteten Detektionsmethoden leicht bestimmt werden konnten. Im gemessenen Spektrum wurde für jedes Gas ein charakteristischer Ausschlag ermittelt.
Da die verwendete Elektrolytflüssigkeit in den untersuchten Li-Ionen-Zellen ein Gemisch aus Ethylencarbonat und Ethylmethylcarbonat war, wurden als gasförmige Entstehungsprodukte Kohlenmonoxid, Kohlendioxid, Methan, Ethan und Ethen erwartet, die sich auch tatsächlich wiederfanden (Bild 4).
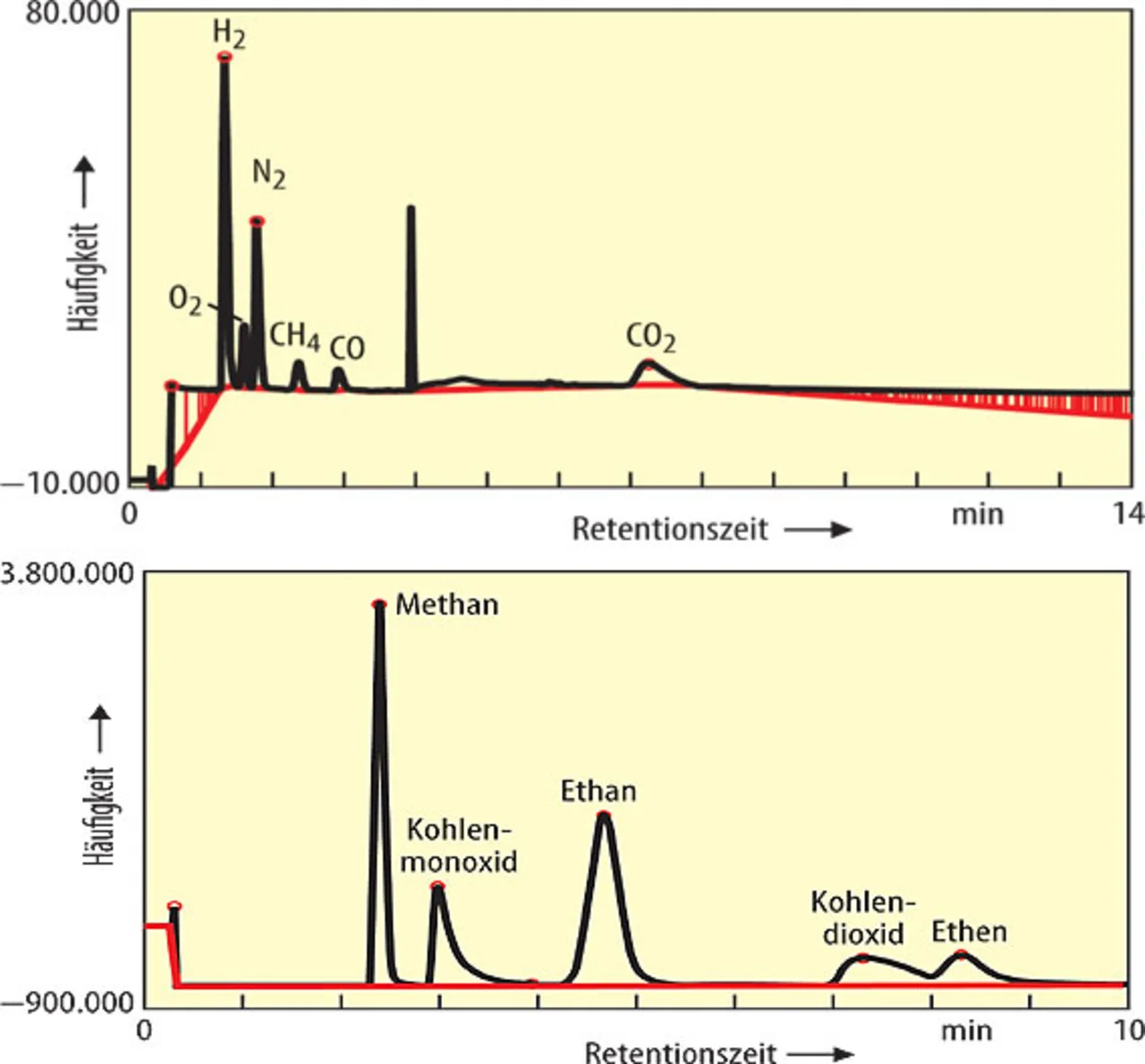
Ein erhöhter Sauerstoffanteil aus dem Zerfall der Metalloxidschichten (Kathode) konnte nicht nachgewiesen werden, da dieser Prozess durch die geringe Überladung noch nicht oder nur gering stattgefunden hatte. Vielmehr entsprach der Ausschlag für Sauerstoff und Stickstoff dem Verhältnis 1:4, was die natürliche Zusammensetzung der Luft wiedergibt.
Überraschenderweise wurde im Überlade- sowie im Tiefentladefall ein sehr hoher Wasserstoffanteil detektiert. Im Überladefall betrug dieser ca. 85 %, im Tiefentladefall ca. 42 %. Wasserstoff ist ein sehr leicht brennbares Gas, das mit dem Sauerstoff der Luft explosives Knallgas bilden kann.
Die beim Über- und Tiefentladen von Li-Ionen-Zellen intern ablaufenden Reaktionen sind sehr komplex, und die Entstehung von Wasserstoff wird in der Fachwelt noch diskutiert. Es wird jedoch vermutet, dass Wasserstoff aus der Reaktion zwischen dem interkalierten Lithium und dem verwendenten fluorinierten Binder entstammen könnte.
Literatur
[1] www.ict.fraunhofer.de
Der Autor:
| Dr. Jochen Mähliß |
|---|
| studierte Chemie an der Goethe-Universität in Frankfurt und promovierte im Juni 2006 am dortigen Anorganischen und Analytischen Institut. Seit Oktober 2010 ist er bei der batteryuniversity.eu GmbH angestellt und seither dreht sich bei ihm alles um elektrochemische Energiespeicher. |
jochen.maehliss@batteryuniversity.eu
- Gefährdungspotenzial von Li-Ionen-Zellen
- Was passiert beim Überladen und Tiefentladen?



